
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вычисление рН в растворах слабых многоосновных кислот
|
|
|
|
Многоосновные кислоты ионизируются в несколько стадий, например ионизация угольной кислоты:
Н2СО3 ↔ Н+ + НСО3- (первая ступень)
НСО3- ↔ Н+ + CO32- (вторая ступень)
Константы ионизации угольной кислоты соответственно равны:
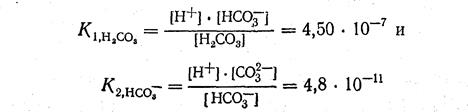
Поскольку первая константа ионизации значительно больше второй, концентрация ионов водорода будет определяться в основном ионизацией угольной кислоты по первой ступени и может быть вычислена по формуле:

Например, при концентрации угольной кислоты, равной 0,01 М,

Итак, при вычислении рН раствора многоосновной слабой кислоты обычно принимают во внимание лишь первую ступень ионизации. Это возможно в тех случаях, когда константа ионизации кислоты по первой ступени в 1000 раз больше константы ионизации этой кислоты по второй ступени.
Вычисление рОН и рН в растворах щелочей и оснований.
В растворах сильных щелочей рОН вычисляется, исходя из 100 % ионизации гидроксида и учета ионной силы раствора.
Пример 6. Вычислить рОН и рН 0,05 н. раствора гидроксида калия.
Решение.
1. Находим активность ионов ОН- в данном растворе:
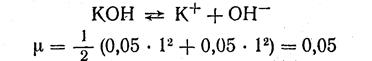
При ионной силе 0,05 f он- = 0,81.
а OH- = [ОН-] · f он- = 0,05 · 0,81 = 0,0405, или 4,05 ·10-2 г-ион/л
2. По найденной а OH- вычислим рОН:
pOH = -lg а OH- = -lg4,05 · 10-2 = 1,39
3. pH =14 — рОН = 14 — 1,39 = 12,61
Пример 7. Вычислить рН раствора, содержащего 3,427 г гидроксида бария Ва(ОН)3 в 1 л.
Решение.
1. Вычислим молярную концентрацию гидроксида бария:
СМ = m/M = 3,427 / 171,35 = 0,02 моль/л
2. Вычислим активность ионов ОН-.
Гидроксид бария — сильный электролит. Следовательно,
Ва(ОН)2 ↔ Ba2+ + 2OH-
Концентрации ионов в растворе соответственно равны:
[Ва2+] = 0,02 г-ион/л, [ОН-] = 2 · 0,02 = 0,04 (г-ион/л)
3. Найдем а OH- с учетом ионной силы раствора:
| m = | (0,02 · 22 + 0,04 · 12) = 0,06 | |
При ионной силе. равной 0,06, f он-» 0,81. Следовательно,
|
|
|
а OH- = 0,04 · 0,81 = 0,0324, или 3,24 · 10-2 г-ион/л
4. рОН = -lg3,24 · 10-2 = 1,49
5. рН = 14 — рОН = 14 - 1,49 = 12,51
В процессе качественного анализа часто приходится определять величину рН исследуемых растворов. Существует много методов определения рН, простейший из них индикаторный.
В учебных лабораториях качественного анализа последовательно применяют пять индикаторов, изменяющих окраску в следующих областях перехода или интервалах значений рН (табл. 3.1).
Таблица 3.1 Область перехода и окраска кислотно-основных индикаторов в кислой и щелочной средах
| Индикатор | Область перехода | Окраска | |
| кислотной формы | щелочной формы | ||
| Метиловый оранжевый Метиловый красный Лакмус Феноловый красный Фенолфталеин | 3,1 — 4,4 4,4 — 6,2 5,0 — 8,0 6,8 — 8,0 8,0 — 10 | Розовая Красная Красная Желтая Бесцветная | Оранжево-желтая Желтая Синяя Красная Малиновая |
Но чаще пользуются лишь тремя индикаторами: метиловым оранжевым, лакмусом и фенолфталеином. Для определения рН отдельным пробам исследуемого раствора последовательно прибавляют по 1—2 капли каждого индикатора и по изменению окраски индикаторов судят о приблизительном значении рН раствора. В настоящее время для определения рН растворов часто пользуются универсальными индикаторами — смесями из нескольких простых индикаторов, позволяющих определять величину рН в широком интервале значений с точностью до 1—2 единиц рН. Универсальный индикатор Кольтгофа состоит из смеси пяти веществ: иметиламиноазобензола, бромтимолового, метилового красного, фенолфталеина и тимолфталеина. В зависимости от величины рН индикатор принимает различные окраски (табл. 3.2).
Таблица 3.2 Зависимость окраски индикатора Кольтгофа от рН
| рН | Окраска индикатора | рН | Окраска индикатора |
| Красная Красно-оранжевая Оранжевая Желто-оранжевая Лимонно-желтая | Желто-зеленая Зеленая Сине-зеленая Фиолетовая |
Универсальный индикатор применяется или в виде раствора, каплю которого смешивают на капельной пластинке с 1—3 каплями исследуемого раствора, или же в виде индикаторной бумаги. К пачке индикаторной бумаги прилагается цветная шкала, показывающая, какие краски принимает бумага при различных величинах рН. Практически рН определяется так: на полоску индикаторной бумаги наносят каплю исследуемого раствора. Полученную окраску индикаторной бумаги сравнивают с окраской шкалы и по шкале определяют рН с точностью до единицы. Для более точного определения рН пользуются приборами Михаэлиса, Алямовского и потенциометрами, методика использования которых дается в учебниках количественного анализа и физической химии.
|
|
|
|
|
|
|
|
Дата добавления: 2015-06-30; Просмотров: 7566; Нарушение авторских прав?; Мы поможем в написании вашей работы!