
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методика решения типовых заданий. Задание 1.Газообразный этиловый спирт можно получить при взаимодействии этилена С2Н4(г) и водяных паров
Задание 1. Газообразный этиловый спирт можно получить при взаимодействии этилена С2Н4(г) и водяных паров. Напишите термохимическое уравнение этой реакции, вычислив её тепловой эффект при стандартных условиях. Сколько теплоты выделится, если в реакцию вступило 5,6 г С2Н4?
Решение:
Составим термохимическое уравнение реакции:
С2Н4(г)+Н2О(г) = С2Н5ОН(г), ΔН0х.р=?
Необходимое значение теплового эффекта реакции вычислим, применяя следствие закона Гесса:
 .
.
Подставляем табличные значения величин ΔН0:
ΔН0х.р = -235,31 - 52,28-(-241,84) = - 45,76 кДж.
Как следует из термохимического уравнения, это количество теплоты выделяется при участии 1 моль С2Н4. По условию задачи имеем 5,6 г: 28 г/моль = 0,2 моль С2Н4. Следовательно, количество теплоты равно: 0,2 ·45,76 = 9,152 кДж.
Задание 2. На основании стандартных энтальпий образования и стандартных энтропий веществ вычислите ∆ G0298 реакции
NH3(г) + HCl(г) = NH4Cl(к).
Чем можно объяснить то, что ∆S0 < 0?
Решение:  определяем из уравнения ∆G0 = ∆H0 - T∆S0.
определяем из уравнения ∆G0 = ∆H0 - T∆S0.
 ;
;

= -315,39 - (-46,19) - (-92,31)= -176,89 кДж/моль;
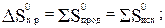

= 94,5-192,50-186,68 = -284,68 Дж/(моль·К) = - 0,2847 кДж/(моль·К);
∆G0=-176,89 - 298(-0,2847)= - 92,08 кДж.
Энтропия есть мера неупорядоченности состояния вещества. Значение энтропии для газообразного состояния значительно выше, чем для кристаллического. Так как реакция идёт с уменьшением объёма газа (в левой части 2 объёма, а в правой – 0), то энтропия системы уменьшается.
Задания к самостоятельной работе
31. Определите ∆ 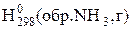 на основании следующих данных:
на основании следующих данных:
4NH3(г) + 3O2(г) = 2N2(г) + 6H2O(ж); ∆ 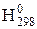 = -1530 кДж;
= -1530 кДж;
∆ 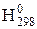 (обр.Н2Ож) = -285,84 кДж/моль.
(обр.Н2Ож) = -285,84 кДж/моль.
32. Определите ∆ 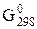 для реакции 2NO + O2 = 2NO2,
для реакции 2NO + O2 = 2NO2,
если ∆ 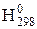 (обр.NО2,ж) = 335,5 кДж/моль,
(обр.NО2,ж) = 335,5 кДж/моль, 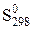 (O2)= 205,0 Дж/моль·K,
(O2)= 205,0 Дж/моль·K,
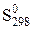 (NO)= 210,6 Дж/моль·K. Возможна ли эта реакция при стандартных условиях?
(NO)= 210,6 Дж/моль·K. Возможна ли эта реакция при стандартных условиях?
33. При взаимодействии 4,2 г железа с серой выделилось 7,54 кДж теплоты. Составьте термохимическое уравнение и вычислите ∆ 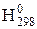 (обр.FeS,ж).
(обр.FeS,ж).
34. Прямая или обратная реакция CH4(г) + CO2(г) ⇆ 2CO(г) + 2H2(г) будет протекать при стандартных условиях?
∆ 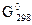 (обр.CH4,г) = -50,79 кДж/моль; ∆
(обр.CH4,г) = -50,79 кДж/моль; ∆ 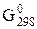 (обр.СO,г) = = -137,27 кДж/моль. Не проводя вычислений определите знак ∆
(обр.СO,г) = = -137,27 кДж/моль. Не проводя вычислений определите знак ∆ 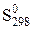 .
.
35. При какой температуре наступает химическое равновесие в системе 4HCl(г) + O2(г) ⇄ 2Н2O (г) + 2 Сl2 (г); ∆ H0 = -114,42 кДж?
S  (HCl,г) = 186,68
(HCl,г) = 186,68  ; S
; S  (О2,г)=205,03
(О2,г)=205,03  ;
;
S  (Н2О,г)=188,72
(Н2О,г)=188,72 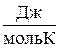 ; S
; S  (Cl2,г)= 222,95
(Cl2,г)= 222,95 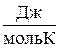 .
.
36. Не производя вычислений, установите знак ∆S0 для следующих процессов:
а) N2 + 3H2 → 2NH3;
б) N2 + O2 → 2NO;
в) 2H2S (г) + 3 O2 (г) → 2Н2О (ж) + 2SO2 (г);
г) CO2(к) → СO2(г).
37. Определите, возможно ли самопроизвольное течение реакции Pb + CuO → Cu + PbO при стандартных условиях 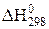 (обр. CuO) = = -162
(обр. CuO) = = -162  ;
; 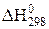 (обр. PbO) = - 219,3 кДж/моль;
(обр. PbO) = - 219,3 кДж/моль; 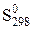 (СuO) = 42,6
(СuO) = 42,6 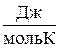 ;
;
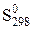 (PbO) = 66,1
(PbO) = 66,1 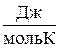 ;
; 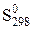 (Pb) = 3,7
(Pb) = 3,7 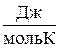 ;
; 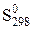 (Сu) = 4,2
(Сu) = 4,2 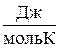 .
.
38. Сформулируйте закон Гесса и следствия из него. Прокомментируйте их на конкретных примерах.
39. На основании следующих данных:
С(графит) + O2(г) = СO2(г); 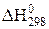 = - 393,5 кДж;
= - 393,5 кДж;
МgO (к) + СО2(г) = МgCO3(к); 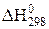 = - 117,7 кДж;
= - 117,7 кДж;
2Mg(к) + О2(г) = 2МgO(к); 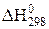 = -1203,6 кДж
= -1203,6 кДж
вычислите 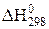 (обр. MgCO3, к).
(обр. MgCO3, к).
40. Почему невозможны при любых температурах реакции, для которых ∆ H > 0, а ∆ S < 0? При каких температурах (низких или достаточно высоких) возможны реакции с положительными значениями ∆ H, ∆ S?
|
|
Дата добавления: 2015-07-02; Просмотров: 1224; Нарушение авторских прав?; Мы поможем в написании вашей работы!