
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Якісний аналіз неорганічних катіонів 2 страница
|
|
|
|
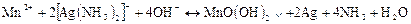
Ця реакція застосовується для виявлення іонів Мn2+ в присутності катіонів II і III аналітичних груп. Реакцію проводять крапельним методом.
Виконання реакції На смужку фільтрувального паперу наносять краплю розчину аміакату срібла і 1-2 краплі досліджуваного розчину. В присутності іонів Мn2+ пляма забарвлюється в коричневий колір.
Оскільки аміакат срібла на фільтрувальному папері частково відновлюється і у відсутності іонів Мn2+ і тому можна помилково виявити іони Мn2+, то слід проводити паралельний дослід з розчином, в якому іони Мn2+ відсутні. Якщо пляма з розчином, що досліджується, виявиться більш інтенсивно забарвленою, ніж пляма паралельного досліду, значить, іони Мn2+ в розчині присутні.
Окиснення іонів Мп2+ в кислому середовищі Іони Мn2+ в кислому середовищі можуть окислюватися до МnО(ОН)2 і до МnО4- - іонів. При дії таких окисників як КClO3 і КBrO3 окиснення проходить до МnО(ОН)2:

Реакція окиснення іонів Мn2+ за допомогою калій бромату застосовується в якісному аналізі для відокремлення іонів Мn2+ від інших катіонів II аналітичної групи.
Виконання реакції. До 5-7 крапель розчину, що досліджується, добавляють 5 - 7 крапель концентрованої азотної кислоти і декілька кристаликів сухої солі КВrО3, суміш нагрівають до кипіння і кип’ятять 3-5 хвилин. Після охолодження осад МnО(ОН)2 відокремлюють центрифугуванням, а розчин використовують для виявлення інших катіонів І підгрупи II аналітичної групи.
Окиснення іонів Мп2+ дією свинець діоксиду РbО2- Іони Мn2+ окиснюються в кислому середовищі до МnО4--іонів, які мають малиново-фіолетове забарвлення. Кращим окисником для цієї реакції є свинець діоксид РbО2:

Виконання реакції. В пробірку вміщують трохи (0,2 г) сухого РbО2, добавляють 10 - 15 крапель концентрованої HNOз і слідові кількості розчину, що досліджується. Для цього кінчик скляної палички змочують розчином, що досліджується, і цей кінчик умочують у розчин HNOз в пробірці. Суміш в пробірці нагрівають до кипіння і кип’ятять 2 - 3 хвилини. Після осідання осаду РbО2 розчин забарвлюється в малиново-фіолетовий колір, якщо в ньому присутні іони Мn2+.
|
|
|
Окиснення іонів Мп2+ дією амоній персульфату (NН4)2S2О8. Амоній персульфат (NН4)2S2О8 в присутності іонів Аg+ як каталізатора окиснює іони Мn2+ до МnО4-. Розчин забарвлюється в малиново-фіолетовий колір:
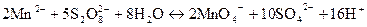
Виконання реакції У пробірку вміщують 2-3 кристалики (NН4)2S2О8 (або 1,0 мл 50% його розчину), добавляють 0,5 мл 2 н. розчину HNO3 і 2-3 краплі 0,1 н. АgNO3. Суміш нагрівають (не кип’ятять), у гарячий розчин занурюють скляну паличку, змочену досліджуваним розчином, і нагрівають до 50-70°С пробірку протягом 1-2 хвилин. В присутності Мn2+-іонів розчин забарвлюється в малиново-фіолетовий колір.
Виявлення іонів Мп2+ за допомогою бензидину.

Бензидин в кислому середовищі в присутності окисників, в тому числі і МnО(ОН)2, окиснюється в бензидинову синь.
Виявленню іонів Мn2+ за цією реакцією заважають іони Аg+, Ві3+ і окисники.
Виконання реакції. На смужку фільтрувального паперу наносять краплю розчину, що досліджується, на цю краплю добавляють 2 - 3 краплі розчину лугу. При цьому утворюється гідроксид марганцю Мn(ОН)2. Через 3 - 5 хвилин на пляму наносять 1 краплю оцтовокислого розчину бензидину. В присутності марганцю пляма синіє.
Дія калій гексаціаноферату (II) К4[FeCN)6]. В присутності іонів NH4+ калій гексаніаноферат (II) утворює з іонами Са2+ білий осад КNН4Са[Fе(СN)6] або (NH4)2Ca[Fe(CN)6]:
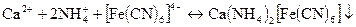
Осад не розчиняється в оцтовій кислоті. Реакцію слід виконувати при рН>7,0. Реакції не заважають іони Sr2+.
Виконання реакції. До 2 - 3 крапель розчину в пробірці добавляють декілька крапель аміачно-амонійного буферного розчину і 2 - 3 краплі К4[Fе(СN)6]. Пробірку з розчином нагрівають до кипіння. При наявності іонів Са2+ випадає білий осад.
|
|
|
Реакція забарвлення полум’я. Леткі солі барію, стронцію і кальцію забарвлюють полум’я в жовто-зелений, карміновочервоний і червоний колір відповідно.
Реакції іонів Fе2+, Al3+
Реакції іонів Fе2+
а) Дія калій гексаціанофорату (III) К3[Fе(CN)6] Іони Fе2+ утворюють з гексаціанофератом (ІІІ)-іонами осад темно-синього кольору, так звану турнбулеву синь Fе3[Fе(СN)6]2.
Ця реакція є характерною для виявлення іонів Fе2+:

Осад не розчинюється в кислотах, але розкладається лугами, в результаті чого утворюється Fе(ОН)2.
б) Окиснення Fе2+ до Fе3+. В той час, як іони Fе3+ проявляють властивості слабого окисника, іони Fе2+ легко окиснюються багатьма окисниками. Для переведення Fе2+ в Fе3+ частіше за інші окисники застосовується азотна кислота при нагріванні:

Реакції іонів Аl3+
Дія NН4ОН А13+-іони при взаємодії з розчином NН4ОН утворюють малорозчинний гідроксид алюмінію А1(ОН)з білого кольору: А1(ОН)з розчиняється у надлишку лугів з утворенням

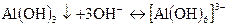
комплексного гексагідроксоалюміната (II) - іону [А1(ОН)6]3-.
При кип’ятінні лужного розчину [А1(ОН)6]3-; в який введено високу концентрацію NH4+-іонів (насичений розчин солі амонію), випадає білий аморфний осад А1(ОН)3:

Ця реакція часто використовується для виявлення іонів А13+.
Реакція іонів Аl3+ з алізарином S та алюмінатом. - Іони АІ3+ з алізарином S (натрієвою сіллю 1,2-діокснантрахінон-3-сульфокислоти) утворюють внутрішньокомплексну сполуку червоного кольору, яка не розкладається в оцтовій кислоті: А1(ОН)[С14H5O3(OH)2SO3Na]2. Іони Fе3+, Вi3+, Сu2+ заважають реакції, оскільки вони теж утворюють забарвленні осади.
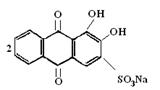 |

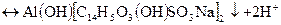
За цією реакцією іони АІ3+ виявляють в слабкокислому середовищі при рН=4,2-4,6. В таких умовах алізарин S має жовтий колір. У лужному середовищі реактив має фіолетове забарвлення, маскує при цьому червоний колір алізаринату алюмінію і заважає виявленню іонів АІ3+.
Виконання реакції. До 3-5 крапель розчину, в якому виявляють іони А13+, добавляють 2 н. розчин NаОН до сильно лужної реакції. Якщо випадає осад, його відокремлюють центрифугуванням. До прозорого центрифугату додають 2-4 краплі 0,2% розчину алізарину S при цьому розчин забарвлюється у фіолетовий колір, і окремими краплями - 2 н. розчин оцтової кислоти до зникнення фіолетового забарвлення. Поява червоного осаду або червоного забарвлення свідчить про наявність в розчині іонів АІ3+.
|
|
|
Реакцію можна виконати краплинним способом. Для цього на смужку фільтрувального паперу наносять краплю розчину K4[Fe(CN)6] і в центр утвореної плями вносять краплю розчину, в якому виявляють іони А13+. При цьому всі катіони II, III і V аналітичних груп, які можуть заважати виявленню іонів Аl3+, осаджуються у вигляді малорозчинних гексаціанофератів і залишаються в центрі плями, тоді як іони А13+ дифундують на периферію плями.
Після цього пляму обробляють аміаком; тримаючи папір з плямою над отвором склянки з розчином аміаку і змочують зовнішню зону плями розчином алізарину S. Потім знову обробляють пляму газоподібним аміаком. Папір з плямою висушують і зовнішню зону плями змочують розчином оцтової кислоти. Поява рожевого кільця на зовнішній зоні плями свідчить про наявність в розчині іонів А13+.
Алюмінон-амонійна сіль ауринтрикарбонової кислоти:
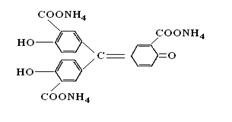
утворює з іонами А13+комплексну сполуку червоного кольору.
Виконання реакції. До 2-3 крапель розчину добавляють 2-3 краплі оцтової кислоти, 2-4 краплі 0,1% розчину алюмінону, нагрівають, добавляють розчин NH4ОН до запаху і 2-3 краплі 2М розчину (NН4)2СОз. У присутності іонів А13+ випадає червоний осад або розчин забарвлюється в червоний колір.
Іони Fе3+, Вi3+, Сu2+ та деяких інших металів заважають, виявленню іонів алюмінію за цією реакцією. їх можна відокремити від іонів Аl3+ осадженням гідроксидів надлишком NаОН або КОН. Потім прозорий центрифугат, в якому знаходяться гідроксоалюмінат-іони [Аl(OН)6]3- підкислюють оцтовою кислотою і далі реакцію виявлення іонів Аl3+ виконують, як описано вище.
Реакції іонів Fe3+
Дія NH4ОН на іони Fe3+, Вi3+. При взаємодії іонів Fе3+ і Ві3+ з розчином NH4ОН утворюються осади коричневого гідроксиду заліза Fе(ОН)3 і білого гідроксиду вісмуту Ві(ОН)з:
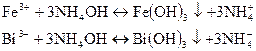
Осади розчиняються в кислотах, але не розчиняються в лугах і надлишку гідроксиду амонію
|
|
|
Дія гексаціаноферату (II і III) К4Fе(СN)6] і K3[Fe(CN)6]. Іони Fe3+ утворюють з калій гексаціанофератом (II) темно-синій осад Fe4[Fe(CN)6] так званої “берлінської лазурі”:
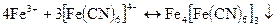
Ця реакція є характерною реакцією на іони Fе3+. Осад Fе4[Fе(СN)6]3 не розчиняється в розведених мінеральних кислотах, але розчиняється при добавленні великого надлишку реактиву. При дії лугів осад розкладається з утворенням гідроксиду заліза (III):

Перебігу реакції заважають аніони, які утворюють з іонами Fе3+ більш стійкі комплексні сполуки: PO43-, C2O42-, F- тартрат-іони та інші.
Виконання реакції. До 2-3 крапель розчину в пробірці добавляють 2-3 краплі розчину К4[Fе(СN)6]. В присутності Fе3+-іонів утворюється осад синього кольору.
Реакція придатна для виявлення іонів Fе3+ в суміші катіонів всіх інших аналітичних груп.
Калій гексаціаноферат (III) К3[Fе(СN)6] утворює з іонами Fе3+ осад темно-коричневого кольору Fe[Fe(CN)6]:

Дія амоній тіоціанату NH4SCN(KSCN). Іони заліза Fе3+ з роданід-іонами утворюють комплексні сполуки інтенсивно-червоного кольору, в яких склад може змінюватися від Fе(SCN)2+ до [Fе(SCN)б]3- Реакцію виконують в кислому середовищі при рН=2. Виявленню іонів Fе3+ за допомогою тіоціанат-іонів заважають F-, РО43--іони, тартрати, які утворюють з іонами Fе3+ більш стійкі безбарвні сполуки, ніж комплекси заліза (III) з тіоціанат-іонами:

а також сильні окисники, які окиснюють SCN- iони, і сильні відновники, які відновлюють іони Fе3+ до Fе2+-іонів.
Виконання реакції. До 2 - 3 крапель розчину добавляють 1 - 2 краплі хлороводневої кислоти і 3 - 4 краплі розчину (NН4)SCN або КSCN. В присутності іонів Fе3+ розчин забарвлюється в інтенсивно червоний колір.
Реакції іонів Сr3+
Дія NH4OH на іони Сr3+. Іони Сг3+ при взаємодії з розчином NН4ОН утворюють малорозчинний гідроксид хрому Сг(ОН)3 сіро-зеленого кольору.
Cr3++3NH4OH↔Cr(OH)3↓+3NH4+
Осад Сг(ОН)3 розчиняється в кислотах і надлишку лугів:
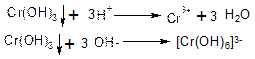
Окиснення іонів Сr3+ до СrО42- іонів в лужному середовищі. В лужному середовищі іони Сг3+ окиснюються до СгО42_ при дії хлорної, бромної води або пероксиду водню:


Іони СгО42_ жовтого кольору. Наявність іонів СrO42- можна підтвердити утворенням в кислому середовищі при дії пероксиду водню надхромової кислоти Н2СrO6 синього кольору.
Виконання реакції. До 3 - 5 крапель розчину, в якому виявляють іони Сг3+, добавляють по краплям розчин NаОН чи КОН до сильнолужної реакції, 5 - 7 крапель 3% розчину Н2О2 і нагрівають розчин до кипіння. Поява жовтого забарвлення внаслідок утворення іону СгО42- свідчить про присутність іонів Сr3+ в розчині.
Потім до 3-5 крапель розчину, одержаного після окиснення іонів Сr3+ до СrО42-, добавляють по краплям НС1 або Н2SО4 до кислої реакції і 0,5 см3 амілового спирту, 5 - 7 крапель розчину Н2О2 і вміст пробірки збовтують. В присутності Сr2О72-_ іонів верхній шар амілового спирту забарвлюється в інтенсивно-синій колір внаслідок утворення легкорозчинної в ньому надхромової кислоти.
Окиснення іонів Сr3+ амоній або калій персульфатом (NH4)2S2O8 (K2S2O8) відбувається в азотнокислому середовищі і в присутності нітрату срібла як каталізатора:


Виконання реакції. До 2 - 3 крапель розчину, в якому виявляють іони Сг3+, добавляють 3-5 крапель 2 н. HNО3, 2 - 3 краплі 0,1 н. розчину АgNO3 5 - 7 крапель 50% розчину (NН4)2S2О8 і суміш нагрівають. В присутності іонів Сг3+ розчин забарвлюється в жовтий колір, внаслідок утворення Сг2О72- іонів. Якщо в розчині присутні іони Мn +2, то з’являється малиново-фіолетове забарвлення, яке обумовлене утворенням іонів МnО4-. Для їх розкладу, а значить і окиснення іонів Cr3+ перманганатом калію КМпО4 відбувається в азотнокислому або сірчанокислому середовищі і у відсутності іонів Сl-, бо останні окиснюються перманганатом і заважають перебігу реакції.
Виконання реакції. До 3 - 5 крапель розчину добавляють З краплі 2 н. розчину Н2S04 або НN03, 1 мл 0,1 н. розчину КМnО4 нагрівають протягом 3 - 5 хвилин. У присутності іонів Сг3+ розчин іабарвлюється в оранжевий колір. У частині розчину після охолодження виявляють іони Сг2О72- утворенням надхромової кислоти Н2СrО6.
Окиснення іонів розчином КМnО4 в слабокислому середовищі супроводжується утворенням темно-бурого осаду МnО(ОН)2:
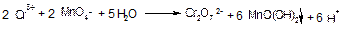
Осад МпО(ОН)2 відокремлюють від розчину центрифугуваням, а в розчині іони Сг2О72- іони виявляють дією Н2О2 в кислому середовищі і утворенням надхромової кислоти Н2СrO6.
Реакції осадження СrО42-(Сr2О72-) іонів. З іонами Аg+, Hg2+, Рb2+ іони СгО42- (Сг2О72-) утворюють малорозчинні хромати:
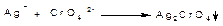
Осад Аg2СгО4 цеглисто-червоного кольору, розчиняється в HNО3, і в NH4OH:

Осад ВаCrO4 жовтого кольору розчиняється в мінеральних кислотах, але не розчиняється в оцтовій кислоті.
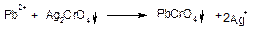
Осад PbCrO4 розчиняється в HNO3 і лугах:

Виявлення іонів Сr3+ в присутності катіонів інших груп.
Бензидин окиснюється біхромат-іонами в кислому середовищі до бензидинової сині: 
Виконання реакції. На годинникове скельце наносять краплю розчину, 2 краплі 3% розчину Н2О2, 2—3 краплі 6 н. NaОН. Суміш трохи нагрівають. Потім за допомогою капілярної трубочки обережно переносять розчин з осадом на фільтрувальний папір так, щоб осад утворювався на папері в місці дотику капіляра. Іони СrO42 дифундують до периферії плями і навколо осаду утворюється кільце, в якому заходяться іони СгО42. Кільце змочують оцтовим бензидином. В присутності СгО42- іонів навколо центра плями утворюється синє кільце. Утворення забарвлених перлів бури з солями хрому.
Н атрій тетраборат Na2В4О7∙10Н2О при сплавленні з сполуками хрому утворює забарвлені в смарагдово-зелений колір перли хромметаборату


Реакції іонів Вi3+
Дія біхромат-іонів на іони Вi3+(К2Сr2О7). Біхромат калію К2Сг2О7 в ацетатному буферному розчині (рН=4-5) утворює з іонами Ві3+ осад біхромату вісмутила (ВіО)2Сг2О7 жовтого кольору:
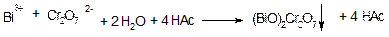
Біхромат вісмутилу розчиняється в мінеральних кислотах і не розчиняється, на відміну від РbСгО4, в лугах.
Взаємодія солей вісмуту з водою. Солі вісмуту, особливо хлориди, гідролізуються, в результаті чого утворюється білий осад вісмутилу хлориду

Дія на іони Ві3+ йодиду калію КI. Калій йодид утворює з іонами Ві3+ чорний осад вісмут йодиду ВіІ3. ВіІ3 розчиняється в надлишку реактиву, внаслідок чого утворюється темно-оранжева комплексна сполукa К[ВіІ4]: 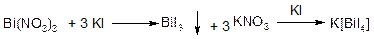
Комплекс КВіІ4 використовується як характерний реагент на алкалоїди (стрихнін, хінін та інші), з якими він утворює сполуки, що не розчиняються у воді.
Реакції відновлення іонів Bi3+ металами: Zп, Fе. Іони вісмуту Ві3+ відновлюються такими металами як залізо, цинк до металічного стану:
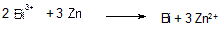
Реакцію виконують в слабкокислому середовищі при рН<7. Перебігу реакції заважають іони Аg+, Нg22+, Нg2+, SbШ, SbV, Сu2+, Аs1II, АsV та деякі інші.
Відновлення іонів Під дією натрій гексагідроксостанату (II) Na4[Sn(OH)6] Іони Ві3+ відновлюються гідроксостанатом (II) [Sп(ОН)6]4- в лужному середовищі до металічного вісмуту чорного кольору:

Перебігу реакції заважають іони Аg+, Нg22+, Нg2+. Гексагідроксостанат (II) повинен бути свіжо-приготовленим. Для цього до розчину SnС12 добавляють NаОН чи КОН, при цьому випадає осад Sп(ОН)2, який розчиняють в надлишку лугу:

Виконання реакції. До 2 - 3 крапель розчину SnС12 в окремій пробірці добавляють при перемішуванні розчин NаОН до повного розчинення осаду Sn(ОН)2. В другій пробірці до 2 - 3 крапель розчину, в якому виявляють іони Ві3+, добавляють в надлишку розчин NaOH при цьому випадає осад гідроксидів металів. До цього осаду приливають розчин гексагідроксостанату (II) з першої пробірки. Почорніння осаду свідчить про присутність іонів Ві3+. При виконанні реакції виявлення іонів Ві3+ за допомогою гексагідроксостанату (II) слід уникати великого надлишку концентрованого розчину лугу: в сильно лужному розчині внаслідок реакції диспропорціювання [Sn(ОН)6]4- може випасти металічне олово у вигляді чорного осаду:

|
|
|
|
|
Дата добавления: 2015-06-28; Просмотров: 663; Нарушение авторских прав?; Мы поможем в написании вашей работы!