
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методы исследования тромбоцитарного гемостаза
|
|
|
|
1. Наименование исследования. Количество тромбоцитов.
Характеристика структуры и свойств клеток. Тромбоциты - безъядерные дисковидные клетки, которые образуются из мегакариоцитов в костном мозге. После выхода в кровь они в течение 7-10 суток циркулируют в кровотоке и частично депонируются в селезенке, а затем утилизируются ретикулоэндотелиальной системой. Размеры большинства их зрелых форм составляют 2,0-3,5 мкм. Как и другие клетки крови, тромбоциты окружены бислойной фосфолипидной мембраной со значительной асимметрией слоев, в которой имеются многочисленные инвагинации. Тромбоцит обладает способностью значительно изменять форму и увеличивать свою площадь при активации.
Большая часть содержащихся в тромбоцитах биологически активных веществ находится в так называемых плотных тельцах, a-гранулах и лизосомах (рис. 2). Большое значение для гемостатических реакций имеет содержимое a-гранул тромбоцитов – фактор V, PDGF, фактор Виллебранда, антигепариновый фактор, фибриноген и др. В плотных тельцах сконцентрированы вещества с небольшой молекулярной массой – серотонин, адениновые нуклеотиды, пирофосфат, Са2+ и др., которые необходимы для поддержания спазма мелких сосудов при повреждении тканей. В лизосомах содержатся гидролитические энзимы – β-глюкуронидаза, β-галактозидаза, кислая фосфатаза, неспецифическая эстераза и др.
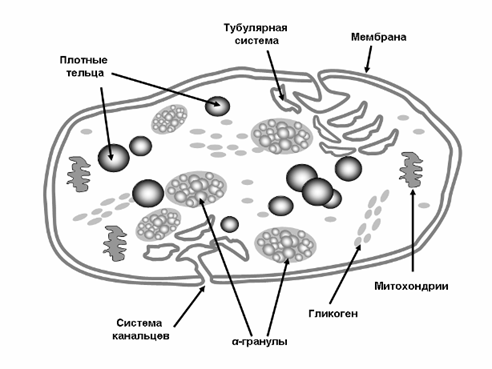
Рис.2. Схематическое изображение неактивированного тромбоцита.
Роль клеток в физиологических процессах. Тромбоциты участвуют в реакциях остановки кровотечения как из мелких (формируя тромбоцитарную пробку), так и из крупных сосудов (способствуя образованию фибринового сгустка). В ответ на контакт с агентами, отличающимися по своим физико-химическим свойствам от нормальных эндотелиальных клеток, тромбоциты изменяют свою дисковидную форму, на их поверхности появляются многочисленные отростки. Одновременно происходит структурная перестройка внутренней части клеток и транспозиция (флип-флоп-переход) мембранных фосфолипидов с отрицательным зарядом на наружную поверхность мембраны. Через канальцевую систему тромбоцитов вещества из гранул и других внутриклеточных структур выделяются в кровь (реакция высвобождения). В результате структурных изменений тромбоциты становятся способными к агрегации и формированию уникальной композиции фосфолипидов в месте повреждения, что значительно увеличивает скорость активации коагуляционных факторов и образование фибрина. После формирования и уплотнения фибринового сгустка на его поверхности тромбоциты образуют атромбогенный монослой, напоминающий по своим свойствам эндотелий.
|
|
|
Основные физиологические функции тромбоцитов представлены в табл. 1.
Таблица 1
Основные функции тромбоцитов.
| 1. Ангиотрофическая функция. 2. Регуляция проницаемости сосудистой стенки. 3. Адгезивная и агрегационная функция. 4. При нарушении целостности сосудов – поддержание спазма артериол за счет выделения биологически активных субстанций. 5. Фиксация сгустка фибрина к месту повреждения сосуда. 6. Участие в активации коагуляционных факторов, формирование протромбиназного комплекса. 7. Участие в активации протеина С. 8. Ретракция фибринового сгустка. 9. Формирование гемостатически нейтральной поверхности сгустка. 10. Репаративная функция. |
Преаналитические особенности. Определение количества тромбоцитов возможно в венозной или капиллярной крови, стабилизированной цитратом натрия или ЭДТА. Пробирки с кровью важно тщательно перемешать путем переворачивания или вращения (без встряхивания). Температура при транспортировке образцов крови должна быть комнатной, поскольку при охлаждении происходит активация и агрегация тромбоцитов. Подсчет тромбоцитов необходимо выполнить в течение 4 час после взятия венозной крови.
|
|
|
Аналитические технологии, методики исследования.
А. Микроскопический метод основан на подсчете тромбоцитов в камере Горяева с использованием обычного микроскопа или прибора с фазовоконтрастной приставкой после разведения крови и лизиса эритроцитов раствором оксалата аммония. Метод требует опыта, напряжения зрения, концентрации внимания. Коэффициент вариации результатов исследования у опытного лаборанта не превышает 10
Б. Подсчет клеток крови в гематологическом анализаторе. Эти приборы существенно облегчают и ускоряют процедуру и повышают точность подсчета тромбоцитов. Коэффициент вариации при подсчете тромбоцитов в гематологических анализаторах – не более 7 % (реально менее 3-5 %). На точность подсчета весьма существенное влияние оказывает качество и надежность используемых калибраторов, а также соблюдение правил преаналитического этапа.
Референтные пределы. У здорового человека в периферической крови содержание тромбоцитов колеблется в диапазоне 150-400×109/л.
Интерпретация результатов. Тромбоцитопения - количество тромбоцитов в периферической крови менее 150×109/л, а тромбоцитоз – более 400×109/л. При сохраненной способности к адгезии и агрегации геморрагический синдром развивается лишь при числе тромбоцитов менее 30´109/л, а угрожающие жизни спонтанные кровотечения в большинстве клинических ситуаций возможны при числе тромбоцитов менее 15´109/л. Эти значения имеют условный характер, поскольку частота и выраженность геморрагий значительно зависят от фонового заболевания, вызвавшего тромбоцитопению, и от функциональной способности тромбоцитов.
Клиническое применение результатов исследования. Тромбоцитопении широко распространены в клинической практике и могут бы как наследственными, так и приобретенными. Их этиологию уточняют на основе жалоб, анамнестических, физикальных и лабораторных данных. Весьма важно начинать диагностический поиск с исключения вторичных форм тромбоцитопений, которые развиваются вследствие нарушения выработки тромбоцитов в костном мозге (гипоплазии и аплазии костного мозга, лейкозы, аномалия Мея-Хеглина, синдром Вискотта-Олдрича), уменьшения продолжительности их циркуляции при спленомегалиях (цирроз печени, синдром Фелти, болезнь Гоше, врожденные гемолитические анемии, тромбоз селезеночной вены, некоторые инфекционные заболевания и др.), при заболеваниях иммунного генеза (антифосфолипидный синдром, лекарственные тромбоцитопении, идиопатическая тромбоцитопеническая пурпура) и при избыточном потреблении в ходе внутрисосудистой коагуляции (ДВС-синдром, болезнь Мошковиц, гемолитико-уремический синдром).
|
|
|
Тромбоцитозы всегда носят приобретенный характер. Реактивные тромбоцитозы часто встречаются после спленэктомии, кровотечений, родов, гемолиза, хирургических вмешательств, а также на фоне онкологических, воспалительных или гнойных заболеваний,при миелопролиферативных заболеваниях (хронический миелолейкоз, миелофиброз, эссенциальная тромбоцитемия, эритремия, мегакариоцитарный лейкоз). Очень часто на фоне этих заболеваний наблюдаются нарушения реологических свойств крови и/или различные аномалии тромбоцитов. В последнем случае, а также при количестве тромбоцитов более 700×109/л, у пациентов повышается риск возникновения тромбозов.
2. Наименование исследования. Длительность кровотечения.
Характеристика теста. Определение длительности кровотечения является способом, позволяющим уточнить состояние сосудисто-тромбоцитарного звена системы гемостаза in vivo.
Роль аналита в физиологических процессах. Ведущая роль в остановке кровотечений в зоне микроциркуляции (артериолы, прекапилляры, капилляры и венулы) принадлежит тромбоцитам. При снижении их количества или при нарушении способности тромбоцитов к адгезии и агрегации часто наблюдается кровоточивость из мелких сосудов кожи и слизистых (микроциркуляторный тип кровоточивости). Такие клинические проявления очень часто сочетаются с удлинением времени кровотечения после стандартного микроразреза кожи.
|
|
|
Преаналитические особенности. Большинство ошибок обусловлено недостаточным опытом выполняющего этот тест персонала. Температура помещения, в котором выполняется исследование, не должна быть ниже 18 оC. При выполнении исследования методом Дьюка для улучшения кровотока рекомендуется согреть мочку уха между пальцами. Ряд медикаментов способен удлинить время кровотечения. В тех случаях, когда применялись лекарственные препараты, содержащие ацетилсалициловую кислоту и другие нестероидные противовоспалительные средства, исследование должно быть отложено на 9-10 суток. Во избежание инфицирования место разреза обрабатывают 70 % раствором этилового спирта. Важно дождаться полного испарения спирта в месте предполагаемого микроразреза, поскольку его попадание в рану приводит к преждевременной коагуляции.
Аналитические технологии, методики исследования.
Определение длительности кровотечения in vivo. Наилучшей воспроизводимостью и относительно малой травматичностью отличается метод Айви (Ivy). Стандартизация в этом методе достигается одинаковой глубиной кожного разреза и созданием стаза в венах верхней конечности путем наложения манжеты сфигмоманометра на плечо и поддержания в ней давления на уровне 40 мм рт. ст., что предупреждает преждевременное склеивание краев раны из-за коллапса венул в области разреза. При достаточном навыке исследователя коэффициент вариации метода не превышает 10%.
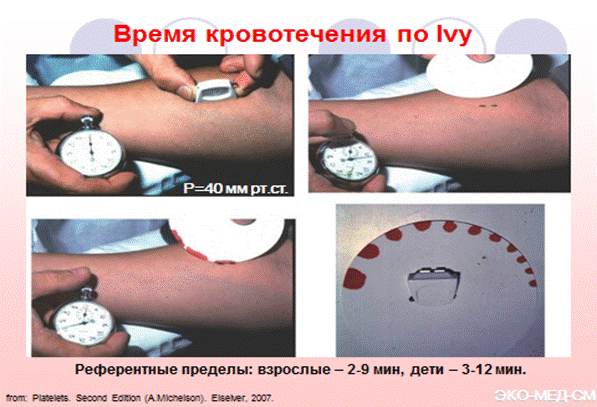
Референтные пределы. в норме не превышает 8 мин, но требуется уточнять нормативы применительно к каждой лаборатории, каждому лаборанту и типу применяемого устройства для надреза кожи.
Интерпретация результатов. Результаты теста следует интерпретировать с учетом данных других анализов, а также наличия или отсутствия клинических геморрагических проявлений у обследуемого. Укорочение длительности кровотечения клинического значения не имеет и чаще свидетельствует о нестандартности процедуры. При тромбоцитопениях, тромбоцитопатиях и болезни Виллебранда время кровотечения удлиняется, при гемофилиях длительность кровотечения в большинстве случаев не отличается от нормы. Значительное удлинение длительности кровотечения, не соответствующее выраженности тромбоцитопении, наблюдается при болезни Бернара-Сулье.
Клиническое применение результатов исследовани я. Тест используется как ориентировочный для выявления пациентов с нарушением функционирования сосудисто-тромбоцитарного звена гемостаза и болезнью Виллебранда; дифференцировать варианты патологии этим методом нельзя.
3. Наименование исследования. Агрегационная функция тромбоцитов.
Характеристика анализируемого явления, его роль в физиологических процессах. Процесс формирования тромбоцитарных конгломератов протекает под действием индукторов (стимуляторов) агрегации. В физиологических условиях самым мощным индуктором агрегации тромбоцитов является тромбоксан А2, менее сильными, но не менее значимыми – АДФ, адреналин, серотонин, гистамин, тромбин, коллаген др.
Преаналитические особенности. Для определения агрегации тромбоцитов образцы венозной крови берут с цитратом натрия (ЭДТА для этой цели непригоден). Для анализа используют богатую тромбоцитами плазму. Часть взятой крови или богатой тромбоцитами плазмы центрифугируют в более жестком режиме (1000 g, 15 мин) для получения бедной тромбоцитами плазмы, которая используется для разведения и в качестве точки отсчета при оценке оптической плотности. Перед проведением анализа производят предварительный подсчет клеток в плазме на гематологическом анализаторе или микроскопическим методом, и в соответствии с полученными результатами богатую тромбоцитами плазму разводят бедной тромбоцитами плазмой (от того же пациента) так, чтобы итоговое количество тромбоцитов в смеси составило 150-250×109/л. При тромбоцитопениях (менее 120×109/л) воспроизводимость результатов значительно снижается.
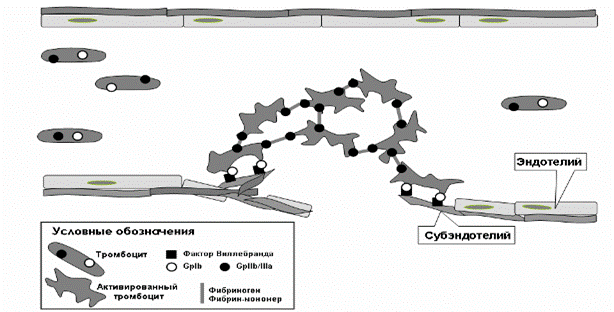
Рис. 3. Схема адгезии и агрегации тромбоцитов.
Интерференции. Гемолиз в образце, относительный недостаток цитрата натрия при низких значениях гематокрита, неточное определение числа тромбоцитов и, как следствие, нестандартное их количество в образце ведут к погрешностям и плохой воспроизводимости результатов. Царапины на пробирках/кюветах могут также быть причиной неточностей из-за ошибок определения оптической плотности богатой и бедной тромбоцитами плазмы. Другой причиной аналитических ошибок может быть некачественная обработка магнитных мешалок при их повторном использовании, поэтому повторное использование пластиковых кювет и магнитных мешалок недопустимо. Высокая скорость вращения магнитной мешалки индуцирует спонтанную агрегацию тромбоцитов, что ведет к завышению результатов.
Аналитические технологии, методики исследования.
А. Оптический способ регистрации агрегации тромбоцитов является наиболее распространенным и хорошо изученным вариантом исследования. Оценку тромбоцитарной агрегации этим методом осуществляют при помощи специального прибора – агрегометра. В основе записи агрегатограммы лежит принцип Борна (Born, 1962), предполагающий графическую регистрацию изменения оптической плотности богатой тромбоцитами плазмы в процессе формирования тромбоцитарных агрегатов после добавления индуктора агрегации (АДФ, адреналин, ристоцетин, коллаген и др.).
Б. Лазерный способ. Агрегометр с использованием лазерного источника света измеряет светорассеяние, возникающее при попадании в луч тромбоцитарных конгломератов.
В. Импедансный способ. Агрегометр с импедансным принципом регистрации определяет изменения электрических свойств цельной крови при добавлении различных стимуляторов агрегации. Графики, полученные при исследовании агрегации тромбоцитов этим способом, похожи на аналогичные «оптические» кривые агрегации, однако временные показатели волн агрегации и их амплитуды не совпадают. Степень агрегации оценивается как электрическое сопротивление (в Омах).
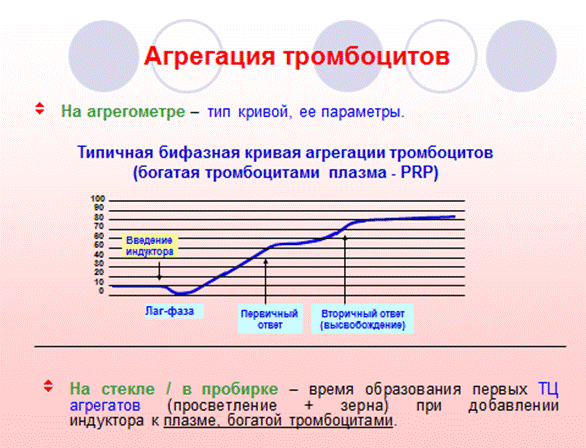
Референтные пределы зависят от многих факторов: модели и конкретного экземпляра агрегометра, используемых реагентов. Ввиду отсутствия общепринятых диапазонов нормальных значений при измерении агрегационной функции тромбоцитов каждая лаборатория определяет нормативы самостоятельно.
Интерпретация результатов. Приобретенные нарушения агрегации тромбоцитов встречаются довольно часто и бывают наиболее выраженными на фоне применения аспирина, других нестероидных противовоспалительных препаратов и анальгетиков. Нарушения также возможны при лечении адреноблокаторами, антагонистами кальция, ксантинами и некоторыми другими препаратами, а также на фоне заболеваний почек, гемобластозов. 
Дифференциальная диагностика вариантов нарушения тромбоцитарной функции основана на оценке агрегации тромбоцитов с различными индукторами (табл. 2).
Таблица 2
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 3211; Нарушение авторских прав?; Мы поможем в написании вашей работы!