
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Равновесия в растворах комплексных соединений
|
|
|
|
Для растворов комплексных соединений характерны следующие превращения:
а) диссоциация на комплексный и внешнесферный ионы, которая протекает почти нацело по типу диссоциации сильных электролитов, например:
K3[Fe(CN)6]® 3K+ +[Fe(CN)6]3-
[Cu(NH3)4](OH)2® [Cu(NH3)4]2+ + 2OH-
б) образование и диссоциация комплексного иона или замещение лигандов молекулами растворителя.
Образование и диссоциация комплексных соединений происходит ступенчато:
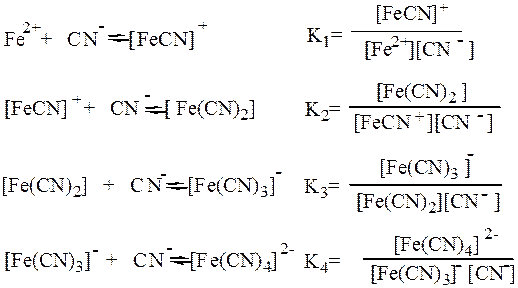
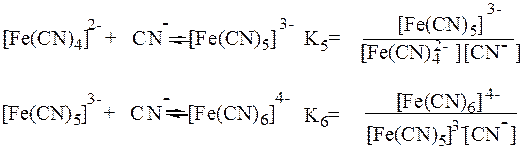
Общая константа образования комплекса b6 равна произведению ступенчатых констант образования:
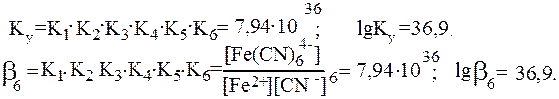
Константы Кn и b (или Ку) являются термодинамическими характеристиками устойчивости комплекса в растворе. Величина, обратная константе образования, называется константой нестойкости комплекса Kн = 1/ b.
Величина константы образования является мерой устойчивости комплекса. Так, комплекс [Co(NH3)6]3+ более устойчив, чем [Cu(NH3)4]2+, поскольку константы устойчивости у них соответственно равны:1,99×1035 и 1,07×1022.
Поскольку образование комплексного иона происходит в результате обмена воды гидратированного иона на соответствующие лиганды, более точно процесс комплексообразования называется обменом лигандов. При добавлении аммиака в водный раствор соли меди связанная с медью вода последовательно замещается аммиаком:
[Cu(H2O)4]2+ +NH3 = [Cu(NH3)(H2O)3]2+ +H2O
[Cu(NH3)(H2O)3]2+ + NH3 = [Cu(NH3)2(H2O)2]2+ +H2O
[Cu(NH3)2(H2O)2]2+ +NH3 = [Cu(NH3)3(H2O)]2+ + H2O
[Cu(NH3)3(H2O)]2+ +NH3 = [Cu(NH3)4]2+ +H2O
К этому обратимому последовательному процессу можно применить закон действующих масс. Константа равновесия, соответствующая суммарной реакции
[Cu(H2O)4]2+ + 4NH3 = [Cu(NH3)4]2+ +4H2O,
является суммарной константой образования или константой устойчивости данного комплекса β4 (или Ку):
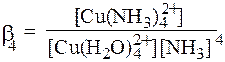
Реакцией, обратной комплексообразованию, является реакция диссоциации. Диссоциация также протекает ступенчато, причём при обмене лигандов с водой координационное число обычно остаётся неизменным. Между константой равновесия и рК прямой и обратной реакций имеет место следующее соотношение:
Диссоциация также протекает ступенчато, причём при обмене лигандов с водой координационное число обычно остаётся неизменным. Между константой равновесия и рК прямой и обратной реакций имеет место следующее соотношение:
Ку(β)=1/Кн; рКу= -рКн,где Кн-константа нестойкости (диссоциации).
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 1635; Нарушение авторских прав?; Мы поможем в написании вашей работы!