
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 1.2.1. Зонная теория твердого тела
|
|
|
|
Полупроводниковые материалы
Из курса атомной физики и квантовой механики известно поведение электронов в отдельно взятом атоме. Электроны в таком атоме могут обладать только определенной энергией или могут находиться только на определенных дозволенных энергетических уровнях. Энергетический спектр электронов приобретает дискретный характер, как это показано на рис. 5.
 На каждом энергетическом уровне, согласно принципу Паули, может находиться не более двух электронов, отличающихся спиновым квантовым числом. Схема энергетических уровней не зависит от того, заполнены они электронами или нет. Переходы электрона с одного энергетического уровня на другой связаны с поглощением или излучением энергии.
На каждом энергетическом уровне, согласно принципу Паули, может находиться не более двух электронов, отличающихся спиновым квантовым числом. Схема энергетических уровней не зависит от того, заполнены они электронами или нет. Переходы электрона с одного энергетического уровня на другой связаны с поглощением или излучением энергии.
Возникает вопрос, как изменяются энергетические уровни электронов в атоме, если отдельные атомы приближать друг к другу, т. е. конденсировать в твердую фазу.
Рассмотрим качественную сторону поставленного вопроса. В изолированном атоме существуют силы притяжения ядром атома всех своих электронов и сила отталкивания между электронами.
В кристалле из-за близкого расстояния между атомами возникают новые силы. Это силы взаимодействия между ядрами и электронами, принадлежащими разным атомам и между всеми ядрами и электронами.
Под влиянием этих дополнительных сил энергетические уровни электронов в каждом атоме кристалла каким-то образом должны измениться. Одни уровни понизятся, другие – повысятся на шкале энергий. В этом состоит первое следствие сближения атомов. Второе следствие связано с тем, что электронные оболочки атомов, в особенности внешние, могут не только соприкасаться друг с другом, но и способны перекрыться.
В результате этого электрон с одного уровня на каком-либо из атомов может перейти на уровень в соседнем атоме без затрат энергии и, таким образом, свободно перемещаться от одного атома к другому. В связи с этим нельзя утверждать, что данный электрон принадлежит какому-нибудь одному определенному атому, наоборот, электрон в такой ситуации принадлежит всем атомам кристаллической решетки одновременно. Иными словами происходит «обобществление» электронов. Такие «обобществленные» электроны обычно называют свободными, а их совокупность – электронным газом или электронами проводимости. Разумеется, что полное обобществление происходит лишь с теми электронами, которые находятся на внешних – валентных электронных оболочках. Чем ближе электрон находится к ядру атома, тем сильней ядро удерживает электрон на этом уровне и препятствует перемещению электронов от одного атома к другому.
Совокупность рассмотренных следствий сближения атомов приводит к расщеплению уровней атома, независимо от того находятся на этом уровне электроны или нет. На энергетической шкале вместо отдельных уровней появляется ряд подуровней или энергетических зон, то есть областей таких значений энергий, которыми может обладать электрон, находясь в пределах твердого тела.
Таким образом, различие между кристаллом и отдельным атомом состоит в следующем. В то время как в изолированном атоме данный энергетический уровень Е(n,l) является единственным, в кристалле, состоящем из N атомов он повторяется N раз. Иначе говоря, каждый уровень изолированного атома в кристалле, расщепляется на N близко расположенных друг от друга подуровней, образующих энергетическую зону (рис. 6). Энергетические зоны, разделенные интервалами энергий DЕз и не принимающие электроны, называются запрещенными зонами. С ростом энергии ширина запрещенной зоны уменьшается, так как имеет место сильное расщепление высокорасположенных атомных уровней.
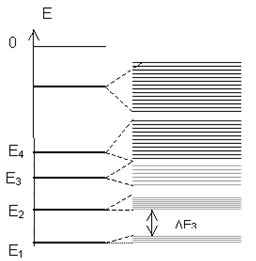
Рисунок 6 - Энергетический спектр электронов в кристалле
Расстояние между подуровнями в зоне кристалла очень мало. В кристалле объемом 1 м3 содержится N = 1028 атомов. При ширине зоны порядка 1эВ расстояние между подуровнями в ней порядка 10-28 эВ. Тем не менее, из-за того, что число уровней в зоне конечно, наличие подуровней играет важную роль в определении характера распределения электронов по состояниям. В нейтральном изолированном атоме все нижние уровни вплоть до валентного уровня заполнены электронами полностью, а уровни выше валентного свободные.
В кристалле зоны, произошедшие от нижних уровней, также полностью заполнены электронами, и только зона, произошедшая от валентного уровня, может оказаться в ряде случаев, заполнена не полностью. Зону, произошедшую от валентных уровней атомов, образующих кристалл, называют валентной зоной. Наибольшее значение энергии этой зоны (или её вершина) равно Ес.
Степень заполнения валентной зоны электронами зависит, прежде всего, от химической природы атомов из которых состоит кристалл.
В изолированном атоме выше валентного уровня находятся уровни энергий, на которых хотя и нет электронов, но они могут там находиться при возбуждении атома (если атом получит энергию). Точно так же и в кристалле: выше валентной зоны имеются полностью свободные от электронов зоны.
Самую нижнюю из незаполненных зон называют зоной проводимости. Минимальное значение энергии этой зоны (или её дно) равно Еn.
Заполнение зоны проводимости может начаться, если электроны валентной зоны получат дополнительную энергию, достаточную для преодоления потенциального барьера, равного ширине запрещенной зоны DЕз = Еn – Ес, лежащей между валентной зоной и зоной проводимости.
Электрические свойства кристаллов в основном зависят от заполнения электронами этих двух зон: зоны проводимости и валентной.
С учетом заполнения этих зон электронами возможны четыре типа зонных структур кристаллов (рис. 7).
Тип А. Валентная зона заполнена полностью, но запрещенная зона между валентной зоной и зоной проводимости отсутствует, то есть зоны перекрыты (рис. 7, а). В этом случае электроны беспрепятственно могут переходить из валентной зоны в свободную зону проводимости. Такой кристалл будет хорошо проводить электрический ток, и эго электропроводность слабо зависит от температуры. Этот случай соответствует металлам, состоящим из двухвалентных атомов.
Тип Б. Валентная зона заполнена не полностью (рис. 7, б). При приложении к такому кристаллу электрического поля, электроны получают от него энергию и могут переходить на более высокие энергетические уровни в соответствующей зоне. В зонах, лежащих ниже валентной, такой переход не возможен, так как в этих зонах все уровни полностью заполнены электронами. Валентная зона заполнена частично, и в ней переходы электронов будут происходить беспрепятственно, что обеспечивает прохождение электрического тока при любой температуре. Такие кристаллы относятся к проводникам, и этот случай реализуется, например для одновалентных металлов типа натрия.
У металлов этой группы валентная зона является и зоной проводимости.
а б в г
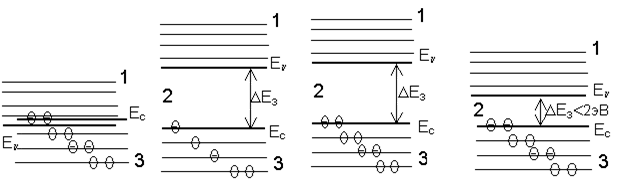
Рисунок 7 - Деление твердых тел на: а и б – проводники; в – диэлектрик;
г – полупроводник без примеси; Т = 0 К; 1 – зона проводимости;
2 – запрещенная зона, 3 – заполненная или валентная зона
Тип В. Валентная зона заполнена электронами полностью и не перекрыта со свободной зоной проводимости (рис. 7, в). Перемещение электронов под действием электрического поля не может происходить, пока каким-либо способом не будет переведена часть электронов из валентной зоны в зону проводимости, преодолев запрещенную зону. Такие кристаллы принято относить к диэлектрикам. Условно принято считать, что кристаллы такого типа будут диэлектриками, если ширина запрещенной зоны DЕз = En – Ec > 2эВ.
Тип Г. Этот случай (рис. 7, г) отличается от типа В только шириной запрещенной зоны. Если ширина запрещенной зоны меньше 2 эВ, то при температурах порядка Т = 300 К часть электронов за счет теплового движения переходят в свободную зону проводимости и под действием электрического поля могут перемещаться в кристалле. Этот случай описывает кристаллы, электропроводность которых повышается при увеличении температуры. Такие кристаллы принято называть полупроводниками.
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 1909; Нарушение авторских прав?; Мы поможем в написании вашей работы!