
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Свойства атомов химических элементов
|
|
|
|
2.1.Атомный радиус. Атом не имеет строго определенных границ. За его радиус принимается расстояние от ядра до главного максимума плотности вешних электронных оболочек. С увеличением заряда ядра в периодах атомный радиус немонотонно уменьшается, а в группах увеличивается.
2.2.Признаком металличности элементов является их способность терять свои валентные электроны.
| Ме0 - е | 
| Ме+ | реакция окисления |
| восстановитель |
Мера металличности элементов является мерой их восстановительной способности. Металличность элементов имеет количественную характеристику - энергию ионизации ЕI, эВ/ат. Энергия ионизации – энергия, необходимая для отрыва электрона от атома.Чем ниже эта энергия, тем более активным металлом является данный элемент.Электрон самопроизвольно отрывается от атома в том случае, если Еj 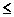 40 эВ/ат.
40 эВ/ат.
2.2.Признаком неметалличности элементов является способность принимать электроны, т.е. окислительная способность.
| Cl0 | + е | 
| Cl- реакция восстановления |
| окислитель |
Количественной характеристикой неметаличности элементов является сродство к электрону – F эВ/ат. Сродство к электрону – энергия, необходимая для отрыва принятого электрона. Чем выше сродство к электрону, тем более сильным окислителем, т.е. неметаллом, является данный элемент. Существует суммарная характеристика сродства к электрону и энергии ионизации. Это так называемая, относительная электроотрицательность элементов. Относительная электроотрицательность ЭО показывает способность атомов притягивать к себе электроны при связывании с другими атомами. Электроотрицательность измеряется в относительных величинах. Наиболее электроотрицательным из всех элементов является фтор (F) - его электроотрицательность в шкале Полинга принята равной 4,0. Остальные элементы по сравнению с фтором имеют меньшую электроотрицательность.
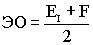
2.3. Характеристика кислородных соединений элементов. элементов.
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 1191; Нарушение авторских прав?; Мы поможем в написании вашей работы!