
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Механизм электрохимической коррозии и термодинамика процесса
|
|
|
|
Обязательным условием реализации электрохимического вида коррозии является наличие электропроводящей среды — растворов кислот, щелочей или солей.
В природных условиях электрохимическая коррозия встречается повсеместно. Это, например, атмосферная, морская, подземная коррозия и др.
Такому виду разрушений подвержены магистральные трубопроводы по транспортировке нефти и газа.
В промышленности электрохимический вид коррозии реализуется в тех случаях, когда процессы протекают в водных технологических средах. Например производство неорганических кислот H2SO4, HNO3, HC1, процессы получения минеральных удобрений, хлора, щелочей и т.д.
Явления на границе раздела фаз металл-электролит
Процессы электрохимической коррозии протекают в водных растворах. При соприкосновении металлической поверхности с раствором электролита происходит взаимодействие металла с заряженными частицами раствора и переход ионов метала в раствор. По представлениям А.Н. Фрумкина и его школы в этом случае протекают два сопряженных процесса:
• переход ионов из металла в раствор с образованием сольва-тированных (в водных растворах — гидратированных) ионов (окислительный или анодный процесс):
Me + mH2O = Меn+ · mН2О + nе
• и переход этих ионов из раствора с выделением их на поверхности металла в виде нейтральных атомов, входящих в состав кристаллической решетки металла (восстановительный или катодный процесс).
Скорости прямого и обратного перехода в общем случае неодинаковы. Если растворение металла происходит быстрее, чем его осаждение, то металл по отношению к электролиту заряжается отрицательно. В результате скорость растворения металла уменьшается, а скорость его осаждения растет. Сдвиг потенциала в отрицательную сторону продолжается до тех пор, пока не будет достигнуто равновесное значение потенциала (Ер). При равновесном состоянии устанавливается динамическое равновесие между скоростями растворения металла и осаждения его ионов, то есть плотность анодного тока (ia) становится равной плотности катодного тока (ik):
ia = ik = i0, (4.1)
где i0 — плотность тока обмена, которая характеризует скорость процесса постоянного обмена ионами между металлом и раствором.
При равновесном потенциале одновременно должны осуществляться два условия:
• на фазовой границе отсутствуют электрохимические и химические превращения;
• потенциал самопроизвольно переходит к одной и той же величине как от более высоких, так и от более низких его значений.
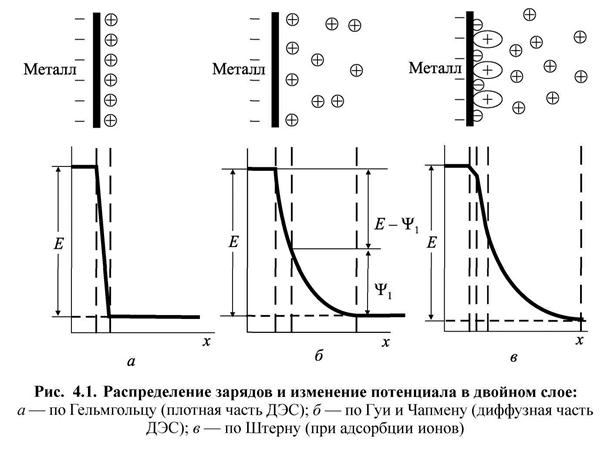
Возникновение разности потенциалов между металлом и раствором означает, что на границе раздела фаз (металл / электролит) должны появиться на некотором расстоянии друг от друга положительно и отрицательно заряженные слои, которые и образуют двойной электрический слой — ДЭС (рис. 4.1).
При переходе катионов металла в раствор поверхность металла заряжается отрицательно. К ней притягиваются положительно заряженные анионы. Возникает двойной электрический слой (ДЭС), который подобен структуре плоского конденсатора (рис. 4.1, а). Такие представления о строении ДЭС были выдвинуты немецким ученым Гельмгольцем. Одна из обкладок конденсатора совпадает с плоскостью, проходящей через поверхностные заряды в металле, а другая — с плоскостью, соединяющей центры тяжести зарядов ионов, находящихся в растворе, но притянутых электростатическими силами к поверхности металла.
Толщина ДЭС принимается равной радиусу гидратированного иона σr, и весь скачок потенциала Ε происходит в этой области (рис. 4.1, а).
Гуи развил представления Гельмгольца о структуре ДЭС, приняв, что слои не плотные, а размытые, поскольку плотный ДЭС будет постоянно разрушаться тепловым движением ионов (рис. 4.1, б). В этом случае ДЭС состоит из плотной и диффузной частей этого слоя.
Соответственно скачок потенциала разбивается на две части: Ψ1 (пси-прим) — изменение потенциала в диффузной части двойного электрического слоя и Ε- Ψ1 — изменение потенциала в плотной части ДЭС. Толщина диффузного слоя в растворах средних концентраций оценивается как 10-7-10-6см.
Штерн ввел еще одно дополнение в картину о структуре двойного слоя. По его представлениям наряду с образованием плотной части этого слоя в результате максимального приближения ионов к поверхности электрода необходимо учитывать и специфическую адсорбцию дипольных молекул и ионов (рис. 4.1, в).
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 1175; Нарушение авторских прав?; Мы поможем в написании вашей работы!