
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Стадия замедленного разряда — ионизации
|
|
|
|
Если самой медленной стадией электрохимического процесса является переход заряженных частиц через границу раздела фаз, то имеет место замедленная стадия разряда — ионизация.
Теория, описывающая кинетические закономерности переноса заряда через границу раздела фаз, называется теорией замедленного разряда. Впервые в качественной форме она была сформулирована М. Фольмером и А.Н. Фрумкиным.
 |
Основная причина влияния скачка потенциала на скорость электрохимических реакций заключается в том, что скорость таких реакций лимитируется стадией переноса заряда, энергия активации которого является функцией потенциала на границе металл-раствор.
DG# a,k - энергия активации процесса окисления, восстановления.
Уравнение Аррениуса
Скорость процесса окисления
ia = aox na F Kox exp(-DG# a/RT)
Скорость процесса восстановления
ik = ared nk F Kred exp(-DG# k/RT)
При равновесном потенциале E 0 DG=0. DG#a = DG#k= DG#
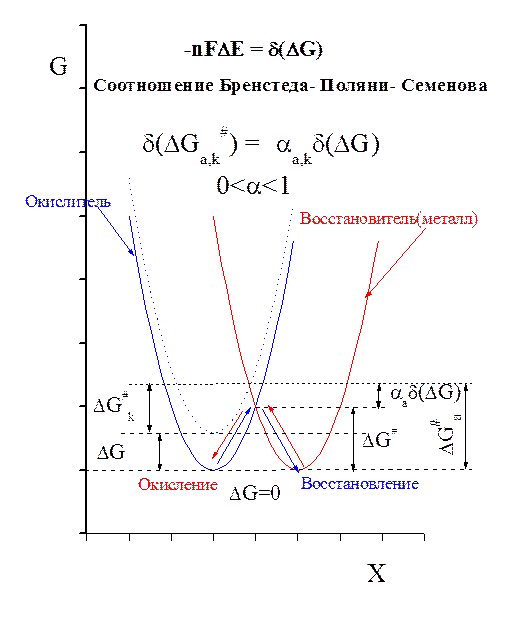 |
DGa = DGk = DG = -nFDE
d(DG) = DG
Катодный процесс
DG + DG#k = DG# + aaDG; DG#k - DG# = -akDG = aknFDE;
DG#k = DG# + aknFDE
Анодный процесс
DG#a = DG# + aaDG; DG#a = DG# - aknFDE
DG = DG#a- DG#k = -(aa + ak)nFDE = -nFDE, но поскольку
DG = -nFDE, то aa + ak =1
Принято обозначать aa как b а ak – как a.
Для реакции
Me → Men+ + ne
Справедливо уравнение Фольмера-Фрумкина.
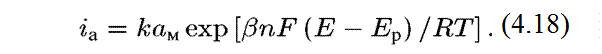
Для простейшего случая протекания процесса в одну стадию, т.е. при одновременном отщеплении n электронов, это уравнение имеет вид:
Здесь iа — скорость анодной реакции, выраженная в единицах плотности тока; а — активность реагента (в данном случае — металла); β — коэффициент переноса для анодной реакции, Ε — электродный потенциал металла в данных условиях; Ер — равновесный электродный потенциал реакции (4.1).
Таким образом, скорость электрохимической реакции зависит от потенциала, изменяясь по экспоненциальному закону. Это — особенность любого электрохимического процесса, в том числе и процесса растворения металла. Для последнего случая следует учитывать, что
активность металла (a Μ), как правило — величина постоянная, так что уравнение (4.18) следует переписать в виде:
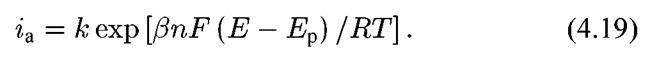
В форме, наиболее удобной для практического использования, уравнение (4.19) целесообразно прологарифмировать:
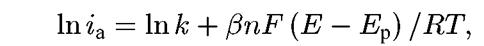
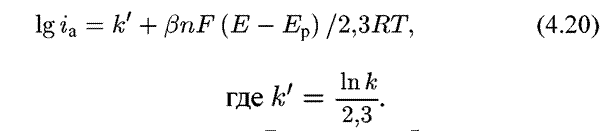 или после перевода натуральных логарифмов в десятичные:
или после перевода натуральных логарифмов в десятичные:
Введение обозначения:
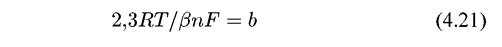 |
приводит к уравнению

где а' — постоянная, а
 |
— характеристика скорости растворения металла.
Поскольку закон, лежащий в основе зависимости iа от Е, выражающейся уравнением (4.22), был сформулирован ученым Тафелем, уравнение это называется уравнением Тафеля. Величину b соответственно называют тафелевым наклоном (имея ввиду наклон линейных кривых в координатах Ε — lg ia, широко используемых при решении научных и прикладных задач, связанных с исследованием электрохимического растворения металлов).
Понятие «наклон» означает, что при изменении плотности тока в 10 раз, что эквивалентно изменению логарифма этой величины на единицу, потенциал электрода, выраженный в мВ, изменяется на величину b.
Величина наклона b является важной характеристикой и в ряде случаев служит аргументом для заключений о кинетике электрохимических реакций.
Например, наклон поляризационных кривых в координатах Ε — lg i позволяет сделать заключение о числе электронов, участвующих в реакции. Рассмотрим случай, когда происходит растворение металла в одну стадию:
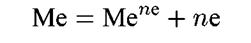
Предположим, что металл может переходить в раствор как в форме одновалентных Ме+, так и двухвалентных Ме2+ катионов. В любом случае для описания скорости реакции применимо уравнение (4.22), где наклон b = 2,3RT/bnF. Поскольку, как правило, β ~ 0,5, то при температуре 20 °С при подстановке численных значений констант R и F получаем:
для случая n = 1 величина b = 118 мВ;
для случая n = 2 величина b = 59 мВ.
Поляризационная кривая в общем случае имеет вид, изображенный на рис. 4.6 в координатах Ε — lgi.
Участок АВ отвечает малому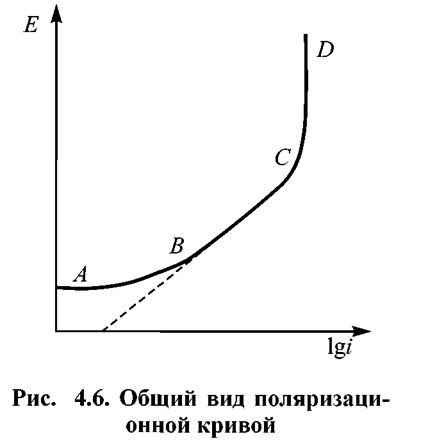
значению поляризации. Следует учитывать, что экспериментально измеряют сумму i = ia+ik. На участке AB вклад ik в i значителен, поэтому AB не линеен. На участке ВС наблюдается тафелевская зависимость между Ε и lg i., и наконец, CD — это область предельного диффузионного тока.
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 1861; Нарушение авторских прав?; Мы поможем в написании вашей работы!