
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Метаболизм углерода при фотосинтезе
|
|
|
|
Фиксация углерода углекислого газа и восстановление его до уровня органических соединений — заключительный этап фотосинтеза. Реакции ассимиляции углерода получили название темновых реакций фотосинтеза. Однако в настоящее время установлено, что для их прохождения необходим свет, поэтому заключительный этап фотосинтеза принято сейчас называть метаболиз-том углерода при фотосинтезе, или углеродными циклами фотосинтеза. При ассимиляции углерода используются продукты световой стадии фотосинтеза — АТФ и НАДФН.
Фиксация углекислого газа из атмосферы и включение его в органические соединения у разных групп растений может происходить по-разному. В соответствии с механизмом первичных реакций фиксации углекислого газа и природой образующихся при этом первых стабильных продуктов различают: С3-путь фотосинтеза, С4-путь фотосинтеза и фотосинтез по типу толстянковых — САМ-фотосинтез (от crassulacea acid metabolism). Восстановление углерода углекислого газа до уровня углеводов практически у всех фотосинтезирующих организмов происходит по единому пути, называемому восстановительным пен-тозофосфатным циклом (ВПФ-цикл). ВПФ-цикл — основной путь ассимиляции углерода в растениях.
3.8.1. С3-ПУТЬ ФОТОСИНТЕЗА (ЦИКЛ КАЛЬВИНА, ВПФ-ЦИКЛ)
С3-путь фотосинтеза был открыт в лаборатории М.Кальвина (1946—1956) при изучении фотосинтеза у одноклеточных зеленых водорослей с использованием меченого углерода и фосфора. Анализ динамики включения метки в органические соединения показал, что первыми органическими соединениями, содержащими меченый углерод, являются трехуглеродные соединения — 3-фосфоглицериновая кислота (3-ФГК) и 3-фосфоглицериновый альдегид (3-ФГА) (отсюда название «С3-путь фотосинтеза»). Позже метка обнаруживается в углеводах, содержащих от 4 до 7 атомов углерода. М.Кальвину с сотр. удалось установить последовательность превращения углеводов в хлоропластах. На основании этого был открыт восстановительный пентозофосфатный цикл углерода, названный в честь исследователей циклом Кальвина.
|
|
|
Химизм цикла Кальвина. Выделяют три стадии ассимиляции углерода в цикле Кальвина: карбоксилирование, восстановление и регенерацию (рис. 3.40). Все ферменты, осуществляющие фиксацию углерода углекислого газа и его восстановление до Сахаров в цикле Кальвина, находятся в строме хлоропластов.
1. Стадия карбоксилирования. Молекулы углекислого газа воздуха присоединяются к
5-углеродному сахару — рибулозо-1,5-бисфосфату (РуБФ). В результате карбоксилирования РуБФ образуется нестойкое 6-углеродное соединение, которое распадается на 2 молекулы 3-фосфоглицериновой кислоты (3-ФГК) (рис. 3.41). Реакцию карбоксилирования осуществляет фермент рибулозобисфосфаткарбоксилаза (РуБФ-карбоксилаза). Фермент кроме карбоксилазной активности может проявлять оксигеназную активность (см. ниже), поэтому полное название фермента — рибулозобисфосфаткарбоксилазаоксигеназа (4.1.1.39), или сокращенно Рубиско.
Рубиско высших растений и зеленых водорослей — один из наиболее высокомолекуляных белков на Земле: его молекулярная масса 560 кДа. Он состоит из 8 больших (L) (55 кДа) и 8 малых (S) (15 кДа) субъединиц. Большие субъединицы кодируются геном хлоропластов (rbcL), малые — ядерным геном (rbcS). Сборка белка проходит в хлоропластах с участием «белка-няньки» (белок 60 кДа), который кодируется в ядре. Поэтому для сборки функционально активного фермента в хлоропластах необходима согласованная работа двух геномов.


Рис. 3.41. Основные функции РуБФ-карбоксилазы-оксигеназы
Каталитический центр фермента формируют аминокислотные остатки С- и N-концов полипептидов двух больших соседних субъединиц. Таким образом, функционально активной структурной единицей фермента является димер больших субъединиц. В Рубиско высших растений имеется 8 каталитических центров, сформированных 8 большими субъединицами. Малые субъединицы играют регуляторную роль, влияя на каталитическую активность больших субъединиц фермента.
|
|
|
Субстратом карбоксилазной активности фермента является СО2. Присоединение молекулы углекислого газа требует ионов Mg2+. Оптимум рН реакции карбоксилирования около 8,0. Оксигеназная активность Рубиско заключается в окислении РуБФ путем включения в сахар кислорода. В результате образуются 3-ФГК и фосфогликолат (см. рис. 3.41). Эта реакция лежит в основе процесса фотодыхания (см. далее), снижающего синтез углеводов при фотосинтезе.
Карбоксилазная и оксигеназная реакции связаны с работой одних и тех же каталитических центров фермента, вследствие чего существует конкуренция между кислородом и углекислым газом за каталитический центр. При обычном содержании кислорода и углекислого газа в воздухе в среднем на три реакции карбоксилирования приходится одна реакция оксигенирования. Увеличение относительного содержания углекислого газа способствует карбоксилазной активности фермента. Рубиско является ключевым ферментом цикла Кальвина, поэтому регуляция его активности — важнейший фактор регуляции цикла Кальвина в целом (см. ниже).
2. Стадия восстановления. Восстановление 3-фосфоглицериновой кислоты (3-ФГК) до 3-фосфоглицеринового альдегида (3-ФГА) — вторая стадия цикла Кальвина. Она осуществляется в два этапа. На первом этапе происходит фосфорилирование 3-ФГК и образование 1,3-бисфосфоглицериновой кислоты. Реакцию осуществляет фермент фосфоглицерокиназа
(ЕС 2.4.2.3) при использовании АТФ. На втором этапе при участии НАДФН и фермента глице-ральдегид-3-фосфатдегидрогеназы (ЕС 1.2.1.13) идет восстановление 1,3-бисфосфоглицериновой кислоты до 3-ФГА. В стадии восстановления достигается восстановленность углерода до уровня углеводов. 3-ФГА и его изомер дигидроксиацетонфосфат (ДГАФ), в который он легко превращается под действием фермента 3-ФГА-изомеразы (ЕС 5.3.1.1), являются первыми моносахарами, образующимися при фотосинтезе в ходе цикла Кальвина.
|
|
|
Молекулы 3-ФГА (или его изомера ДГАФ) могут быть использованы для регенерации РуБФ — акцептора углекислого газа и экспортированы из хлоропластов в цитоплазму. В цитоплазме автотрофной клетки из триоз синтезируются гексозы (глюкоза и фруктоза) и дисахарид сахароза — главная транспортная форма углеводов в растении.
3. Стадия регенерации. На этой стадии происходит регенерация акцептора углекислого газа РуБФ. В ходе реакций образуются различные углеводы с числом углеродных атомов 4, 5, 6 и 7. Чтобы проследить весь цикл преобразования углеродных скелетов в цикле Кальвина, необходимо представить фиксацию как минимум трех молекул СО2 с использованием трех молекул рибулозо-1,5-бисфосфата. В этом случае после стадии карбоксилирования получаются 6 молекул 3-ФГК, а после их восстановления — 6 молекул 3-ФГА. При этом используются 6 молекул АТФ и 6 молекул НАДФН. Пять молекул 3-ФГА используются для регенерации трех молекул РуБФ, а шестая молекула 3-ФГА может быть выведена из цикла и транспортирована в цитоплазму автотрофной клетки.
В реакциях регенерации РуБФ одна молекула 3-ФГА взаимодействует с ДГАФ с образованием фруктозо-1,6-бисфосфата (фермент фруктозобисфосфатальдолаза, 4.1.2.7), который дефосфорилируется с образованием фруктозо-6-фосфата (фермент фруктозобисфосфатаза, 3.1.3.11). Последний взаимодействует с 3-ФГА с образованием ксилулозо-5-фосфата и
эритрозо-4-фосфата (фермент транскетолаза, активный только в присутствии тиаминпирофосфата — ТПФ). Эритрозо-4-фосфат реагирует с ДГАФ, образуя седогептулозо-1,7-бисфосфат (фермент альдолаза), который затем дефосфорилируется до седогептулозо-7-фосфата (фермент седогептулозобисфосфатаза), который далее взаимодействует с 3-ФГА с образованием ксилулозо-5-фосфата и рибозо-5-фосфата (фермент I транскетолаза). Две молекулы ксилулозо-5-фосфата подвергаются эпимеризации по третьему атому углерода (фермент эпимераза) и превращаются в 2 молекулы рибулозо-5-фосфата. Рибоза-5-фосфат изомеризуется также в рибулозо-5-фосфат (фермент рибозофосфатизомераза). Таким образом, в ходе трансальдолазных и транскетолазных реакций углеродные скелеты перестраиваются и в результате образуется 3 молекулы рибулозо-5-фосфата. Заключительная стадия регенерации акцептора углекислого газа — фосфорилирование трех молекул рибулозо-5-фосфата с образованием трех молекул рибулозо-1,5-бисфосфата. Реакцию катализирует фермент фосфорибулокиназа (2.7.1.19). При этом используются 3 молекулы АТФ. В итоге вновь образуются 3 молекулы РуБФ. Триоза, не использованная для регенерации РуБФ, является продуктом фотосинтеза, который может пойти на синтез гексоз и более высокомолекулярных углеводов как в самом хлоропласте, так и в цитоплазме автотрофной клетки.
|
|
|
Итак, фиксация трех молекул СО2 и синтез одной молекулы триозы в цикле Кальвина потребовали 6 молекул НАДФН и 9 молекул АТФ, т.е. для ассимиляции одной молекулы углекислого газа по С3-пути фотосинтеза необходимо 2 молекулы НАДФН и 3 молекулы АТФ.
Регуляция цикла Кальвина. Система регуляции цикла Кальвина сложно организована и включает метаболический, энергетический и генетический контроль. В основе регуляции лежит возможность изменения направления и
скорости протекания биохимических реакций цикла. Это реализуется, во-первых, за счет изменения каталитической активности ферментов, а во-вторых, за счет влияния метаболитов и коферментов на протекающие процессы по принципу действия масс. Транспорт метаболитов из хлоропластов становится при этом важнейшим фактором регуляции метаболизма углерода.
Регулируемыми, как правило, являются ферменты, катализирующие «необратимые» реакции, т. е. реакции, в ходе которых имеет место значительный отрицательный перепад свободной энергии. В цикле Кальвина «необратимыми» являются 4 реакции: 1) карбоксилирование, катализируемое Рубиско (РуБФ → 3-ФГК, ∆G' = -41 кДж); 2 и 3) две реакции, связанные с работой фосфатаз — фруктозо-1,6-бисфосфатазы (ФБФ → Ф6Ф, ∆G' =-27,2 кДж) и седогептулозо-1,7-бисфосфатазы (СБФ → С7Ф, ∆G' =-29 кДж); 4) фосфорилирование РуБФ, катализируемое фосфорибулокиназой (РуБФ →РуБФ, ∆G' = = -15,9 кДж). Кроме того, две реакции восстановительной стадии, катализируемые ФГК-киназой и трифосфатдегидрогеназой (ФГК →1,3-ДФГК → ФГА) при суммарной небольшой потере энергии в значительной степени подвержены действию метаболитов и зависят от действия масс. Концентрации АДФ, АТФ и ФГК оказывают значительное влияние на прохождение первой из этих реакций и определяют направление ее протекания.
Важной особенностью «регулируемых» ферментов цикла Кальвина является зависимость их активности от света. По крайней мере 5 ферментов цикла Кальвина активируются светом: рибулозобисфосфаткарбоксилаза, триозофосфатдегидрогеназа, фруктозобисфосфатаза, седогептулозобисфосфатаза и фосфорибулокиназа.
Контроль реакций цикла Кальвина светом включает ряд механизмов:
1) световые реакции фотосинтеза обеспечивают синтез АТФ и НАДФН — соединений, непосредственно используемых в цикле Кальвина;
2) создание на свету в строме хлоропластов оптимальных для активности ряда ферментов цикла Кальвина условий рН и концентрации ионов Mg2+;
3) светозависимая ковалентная модификация ферментов цикла Кальвина через систему тиоредоксина (см. рис. 3.1).
Своеобразная ковалентная и конформационная модификация светом происходят в Рубиско:
1) на свету благодаря повышению концентрации магния в строме облегчается присоединение молекулы СО2 и магния к регуляторному центру Рубиско; карбамилизация фермента необходима для проявления его карбоксилазной активности;
2) свет вызывает присоединение к Рубиско низкомолекулярного белка-регулятора активазы, который вытесняет из каталитического центра Рубиско рибулозо-1,5-бисфосфат и его изомер ксилулозо-1,5-бисфосфат, прочно связанные с каталитическим центром фермента в темноте и препятствующие присоединению к нему молекул углекислого газа и магния в отсутствие света.
Таким образом, световая активация цикла Кальвина включает ряд механизмов, изменяющих каталитическую активность ферментов. Одни из них связаны с ковалентными модификациями ферментов за счет восстановления дисульфидных связей или карбамилизации аминогрупп, другие — вызывают нековалентные, конформационные изменения ферментов, обусловленные присоединением метаболитов или созданием оптимальных условий для активности ферментов. Помимо этого свет контролирует содержание ферментов цикла Кальвина на генетическом уровне. Установлено, что свет активирует экспрессию генов малой субъединицы РуБФ-карбоксилаз-оксигеназы через фоторецепторы красного и синего света (см. гл. 7).
3.8.2. С4-ПУТЬ ФОТОСИНТЕЗА (ЦИКЛ ХЭТЧА—СЛЭКА—КАРПИЛОВА)
С4-путь фотосинтеза был впервые обнаружен у двух тропических злаков — кукурузы и тростника. В работах Ю.С.Карпилова (1965), М.Хэтча и К. Слэка (1966) с использованием меченого углерода (14СО2) было показано, что первыми продуктами фотосинтеза у этих растений являются органические кислоты щавелевоуксусная и яблочная — соединения, содержащие 4 атома углерода (отсюда название «С4-путь фотосинтеза»). Позже метка обнаруживалась в фосфоглицериновой кислоте и фосфоглицериновом альдегиде. Анализ динамики включения метки в продукты фотосинтеза позволил определить последовательность происходящих реакций и выявить цикл превращения углерода, отличный от цикла Кальвина, названный впоследствии циклом Хэтча —Слэка. В цикле Хэтча—Слэка растения осуществляют первичную фиксацию углекислоты через карбоксилирование фосфоенолпирувата (ФЕП) при участии фермента ФЕП-карбоксилазы. Вслед за этим происходит синтез малата (или аспартата) — промежуточных продуктов фиксации СО2, которые затем становятся источниками углекислого газа для восстановительного пентозофосфатного цикла. В цикле Кальвина у С4-растений, как и у С3-растений, восстанавливается углерод СО2 и синтезируются углеводы.
Для С4-растений характерна особая структура листа, так называемая кранц-структура (рис. 3.42).
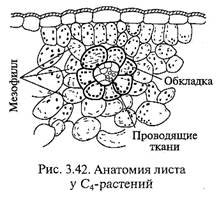
В нем структурно и функционально различают клетки обкладки и клетки мезофилла. Клетки обкладки крупные, плотно прилегают к сосудам листа, хлоропласты в них могут не иметь гран, часто содержат зерна крахмала. Клетки мезофилла мелкие, расположены рыхло; хлоропласты в них всегда имеют граны, редко содержат крахмал. Клетки обкладки связаны с клетками мезофилла множеством плазмодесм, благодаря чему между ними возможен активный обмен метаболитами. Рубиско — карбоксилирующий фермент цикла Кальвина, найден в основном в хлоропластах клеток обкладки, тогда
как в клетках мезофилла обнаружен другой карбоксилирующий фермент — ФЕП-карбоксилаза. В клетках мезофилла проходит цикл Хэтча—Слэка, в клетках обкладки — цикл Кальвина.
Существует ряд модификаций С4-пути фотосинтеза, связанных с химической природой продуктов-переносчиков углекислого газа в клетки обкладки (транспортным соединением может быть малат или аспартат), а также с характером последующих декарбоксилирующих реакций. В соответствии с ферментом, осуществляющим декарбоксилирование в клетках обкладки, различают сле-
дующие три группы С4-растений, использующие для декарбоксилирования разные ферменты:
1) НАДФ-малатдегидрогеназу (например, кукуруза — Zea mays, сахарный тростник — Sacharum officinarum);
2) НАД-малатдегидрогеназу (амарант — Amarantus retrophlexus, портулак — Portulaca oleaceae и др.);
3) ФЕП-карбоксикиназу (например, просо — Panicum maximum, хлорис — Chloris gayana).
Химизм НАДФ-малатдегидразного типа С4-фотосинтеза, характерного для растений первой группы, представлен на рис. 3.43. Как видно из рисунка, в клетках мезофилла происходит первичная фиксация СО2 через присоединение его (в форме НСО  ) к ФЕП с образованием щавелевоуксусной кислоты (ЩУК). Карбоксилирующий фермент ФЕП-карбоксилаза (4.1.1.31), локализованный в цитозоле клеток мезофилла, отличается высоким сродством к НСО
) к ФЕП с образованием щавелевоуксусной кислоты (ЩУК). Карбоксилирующий фермент ФЕП-карбоксилаза (4.1.1.31), локализованный в цитозоле клеток мезофилла, отличается высоким сродством к НСО  . Использование ферментом в качестве субстрата бикарбоната значительно увеличивает скорость фиксации углерода, поскольку содержание в клетке НСО
. Использование ферментом в качестве субстрата бикарбоната значительно увеличивает скорость фиксации углерода, поскольку содержание в клетке НСО  выше, чем углекислого газа. Синтезированная ЩУК переносится в хлоропласты клеток мезофилла и там восстанавливается до малата с использованием НАДФН. Реакцию катализирует фермент малатдегидрогеназа (1.1.1.8.2). Образовавшийся малат по плазмодесмам транспортируется в клетки обкладки. В клетках обкладки происходит реакция окислительного декарбоксилирования малата. Она катализируется ферментом НАДФ-малатдегидрогеназой (декарбоксилирующей) (1.1.1.40). В ходе реакции образуется пируват, выделяется углекислый газ и восстанавливается НАДФ+. СО2 и НАДФН используются в цикле Кальвина, а пируват по плазмодесмам возвращается в клетки мезофилла. В клетках мезофилла пируват превращается в высокоэнергетическую форму ФЕП в реакции, катализируемой ферментом пируватортофосфатдикиназой (2.7.9.1). При этом используются АТФ и неорганический фосфат.
выше, чем углекислого газа. Синтезированная ЩУК переносится в хлоропласты клеток мезофилла и там восстанавливается до малата с использованием НАДФН. Реакцию катализирует фермент малатдегидрогеназа (1.1.1.8.2). Образовавшийся малат по плазмодесмам транспортируется в клетки обкладки. В клетках обкладки происходит реакция окислительного декарбоксилирования малата. Она катализируется ферментом НАДФ-малатдегидрогеназой (декарбоксилирующей) (1.1.1.40). В ходе реакции образуется пируват, выделяется углекислый газ и восстанавливается НАДФ+. СО2 и НАДФН используются в цикле Кальвина, а пируват по плазмодесмам возвращается в клетки мезофилла. В клетках мезофилла пируват превращается в высокоэнергетическую форму ФЕП в реакции, катализируемой ферментом пируватортофосфатдикиназой (2.7.9.1). При этом используются АТФ и неорганический фосфат.

Рис. 3.43. С4-путь фотосинтеза (НАДФ-малатдегидрогеназный вариант)
Пирофосфат, образующийся в реакции, гидролизуется до ортофосфата ферментом неорганической пирофосфатазой (6.6.1.1), а образовавшийся АМФ фосфорилируется за счет АТФ под действием аденилаткиназы. В итоге превращение ПВК в ФЕП требует 2 молекул АТФ.
Расчет затрат АТФ и НАДФН на фиксацию одной молекулы СО2 в С4-пути фотосинтеза показывает, что для этого пути ассимиляции углерода необходимо большее количество АТФ, чем для С3-пути фотосинтеза. Если принять, что в цикле Кальвина у С4-растений, так же как и у С3-растений, для фиксации одной молекулы СО2 используется 3 молекулы АТФ и 2 молекулы НАДФН, то для превращения ПВК в ФЕП в цикле Хэтча—Слэка требуются дополнительные 2 молекулы АТФ. В итоге для осуществления фиксации 1 молекулы СО2 в ходе С4-пути фотосинтеза необходимы 5 молекул АТФ и 2 молекулы НАДФН.
Регуляция С4-пути фотосинтеза. Регуляция включает метаболитный, генетический и световой контроль активности ферментов цикла Хэтча —Слэка. Особое значение при этом имеет регуляция ФЕП-карбоксилазы — ключевого фермента цикла Хэтча—Слэка. Установлено, что
ФЕП-карбоксилаза ингибируется органическими кислотами (в первую очередь малатом). Фосфорилирование ФЕП-карбоксилазы повышает устойчивость фермента к малату. Свет активирует специфическую киназу ФЕП-карбоксилазы, которая фосфорилирует ФЕП-карбоксилазу и тем самым защищает фермент от аллостерического ингибирования малатом. В результате активность ФЕП-карбоксилазы на свету повышается. Кроме того, свет активирует НАДФ-зависимую малатдегидрогеназу через тиоредоксиновую систему и фермент пируватортофосфатдикиназу (ПФДК) — путем активации системы дефосфорилирования фермента.
Таким образом, существует ряд механизмов регуляции С4-пути фотосинтеза на уровне специфических для цикла Хэтча—Слэка ферментов. Вместе с тем, все регуляторные механизмы, отмеченные для С3-пути фотосинтеза в ВПФ-цикле (см. подразд. 8.2.2), реализуются и в С4-растениях.
Растения с С4-типом фотосинтеза отличаются от С3-растений: 1) световое насыщение фотосинтеза достигается у них при более высоких интенсивностях света; 2) у С4 значительно выше скорость фотосинтеза при насыщающих интенсивностях света (40 — 80 мг СО2/дм2 листа в час по сравнению с 15 — 40 мг СО2/дм2 листа в час у С3-растений); 3) температурный оптимум фотосинтеза смещается в область более высоких температур (около 30 — 35 °С); 4) значи- I тельно меньшие потери воды при синтезе органических веществ в ходе фотосинтеза (250 — 350 г воды при увеличении сухого веса на 1 г по сравнению с 450 — 950 г воды/г сухой массы у С3-растений); 5) очень низкий уровень фотодыхания; 6) высокая скорость роста и высокая продуктивность.
|
|
|
|
|
Дата добавления: 2015-07-13; Просмотров: 5555; Нарушение авторских прав?; Мы поможем в написании вашей работы!