
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства сахаров
|
|
|
|
Проекции Фишера удобны для формального рассмотрения и классификации сахаров, но они не отражают истинное строение этих веществ. Глюкоза не образует бисуль-фитное соединение и не дает реакции с фуксинсернистой кислотой, которая характерна для всех альдегидов, но она вступает в реакцию с производными гидразина и с многи-ми другими реагентами подобно другим альдегидам более простого строения. При рас-творении глюкозы в воде образуется раствор с удельным вращением [a]22D +122°, но при стоянии его удельное вращение снижается до +53°. Это явление, называемое мутаротацией, свидетельствует о том, что в растворе кристаллизовавшаяся из воды D‑глюкоза переходит в другую форму с меньшим удельным вращением. В обычных условиях из воды кристаллизуется форма с меньшей растворимостью и с большим удельным вращением, получившая обозначение a, но кристаллизацией из пиридина удалось получить в чистом виде и b-D-глюкозу, удельное вращение которой оказалось равным +18,7°; при ее растворении в воде удельное вращение раствора растет до того же значения +53°.
В основе мутаротации лежит реакция спиртов с карбонильными функциональными группами, протекающая с образованием полуацеталей из альдегидов (R1 = H) и полу-кеталей из кетонов:
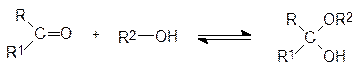
При нагревании с избытком спирта в присутствии кислоты с удалением из реакцион-ной массы воды могут быть получены и полные ацетали (кетали):
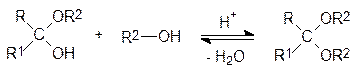
Экспериментально показано, что в молекуле глюкозы есть пять гидроксильных групп, однако одна из них заметно отличается по реакционной способности от четырех остальных. При нагревании со спиртом в присутствии кислоты образуется мономети-ловый эфир глюкозы, а остальные четыре гидроксильные группы метилируются толь-ко метилиодидом в присутствии оксида серебра. Полученная исчерпывающим метили-рованием пентаметилглюкоза гидролизуется водным раствором кислоты по одной эфирной группе, а остальные четыре метоксильных группы устойчивы к гидролизу. И еще: полученная гидролизом пентаметилглюкозы тетраметилглюкоза мутаротирует, то есть удельное вращение плоскости поляризованного света ее растворов в воде изме-няется со временем, выходя на равновесное значение.
|
|
|
Для всего этого есть только одно объяснение: молекулы углеводов имеют как карбо-нильную, так и спиртовые функции, и поэтому они легко образуют стабильные цикли-ческие внутримолекулярные полуацетали, которые в проекциях Фишера для глюкозы изображаются следующим образом:
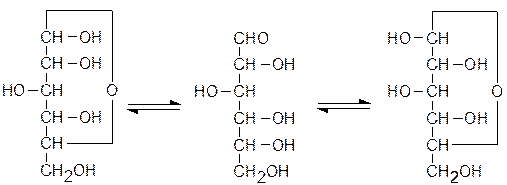
a-D-Глюкоза D-Глюкоза b-D-Глюкоза
С переходом карбонильной группы из sp2 в sp3-гибридизованное состояние появляется новый асимметрический центр, и два соответствующих оптических изомера Фишер предложил обозначать символами a в том случае, когда новая гидроксильная группа расположена с той же стороны, что и кислород гетероцикла, и b, если она на другой от него стороне, правда, так просто это выглядит только в плоской проекции.
Полуацетальная (аномерная) гидроксильная группа значительно отличается по реакци-онной способности от других гидроксигрупп сахаров, и при замещении ее на другие функции образуются производные, называемые в общем случае гликозидами (глюко-зиды, фруктозиды, галактозиды, рибозиды и т.д.). Так, при нагревании глюкозы с мета-нолом в присутствии кислоты образуются метил-a-D-глюкозид и метил-b-D-глюкозид.
У глюкозы образование внутреннего полуацеталя протекает за счет гидроксильной группы у пятого атома углерода и поэтому ее можно рассматривать как производное шестичленного гетероцикла тетрагидропирана. Часто также реализуется пятичленный цикл и тогда сахар является производным тетрагидрофурана. В более приближенных к реальным структурам формулах глюкоза и фруктоза, например, изображаются так:
|
|
|

a-D-Глюкопираноза b-D-Фруктофураноза
Такие циклические полуацетальные структуры могут образовываться только из сахаров с числом атомов углерода больше трех. То есть глицериновый альдегид в растворах не мутаротирует, а диоксиацетон вообще не имеет асимметрического атома углерода. Это и есть тот самый аргумент, о котором уже говорилось выше, для исключения этих соединений из числа сахаров, хотя их роль в биохимии достаточно значима.
Мы уже говорили о том, что все сахара могут быть получены из глицеринового альде-гида. Для этого используется реакция карбонильных групп с синильной кислотой:
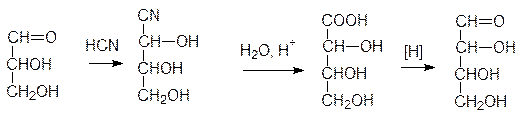
Есть и обратный путь, например:

Аномерная гидроксильная группа легче чем спиртовая вступает в различные реакции замещения. Так, например, именно по этой группе идет реакция с метанолом в присут-ствии кислоты с образованием метилглюкозида, а нагревание пентаацетата глюкозы с концентрированной фосфорной кислотой приводит к образованию тетраацетата a‑D‑глюкозо-1-фосфата, из которого a-D-глюкозо-1-фосфат получают действием рас-твора аммиака в абсолютном спирте.
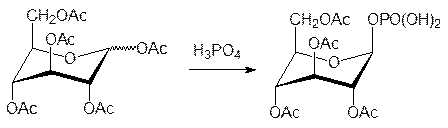
В присутствии концентрированных щелочей из сахаров образуются окрашенные в ко-ричневый цвет продукты. Очевидно, это связано с превращениями по типу альдольной и кротоновой конденсации. Однако, разбавленные щелочи и гидроксиды щелочно-земельных металлов вызывают прегруппировку Лобри-де-Брюйна-ван-Экенштейна. Впервые необычное превращение такого рода отметил Э.Фишер, обнаруживший, что при восстановлении глюкозы амальгамой натрия в воде наряду с сорбитом образуется также маннит:
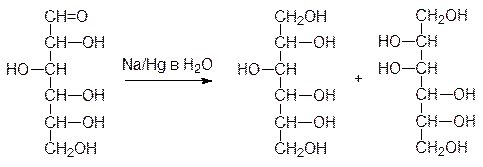
Однако, не найдя объяснения этому экспериментальному факту, Фишер только отме-тил его в своей публикации по реакции восстановления сахаров. Сейчас мы знаем, что в присутствии оснований идет взаимное превращение сахаров, связанное с образова-нием енолов. Так, из глюкозы образуется енольная форма, которая может превратить-ся как снова в глюкозу, так и в маннозу или фруктозу:

Синтез природных соединений, в состав которых входит молекула глюкозы, основан на использовании ряда защитных групп, позволяющих проводить избирательные пре-вращения по отдельным функциональным группам в ее молекуле. Так, например, в водном растворе не удается обнаружить фуранозные формы глюкозы, но при нагре-вании ее с ацетоном в присутствии кислоты с отгонкой образующейся в результате реакции воды образуется 1,2,5,6-диизопропилиден-D-глюкофураноза:
|
|
|
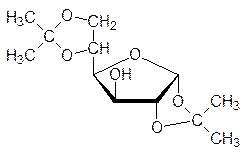
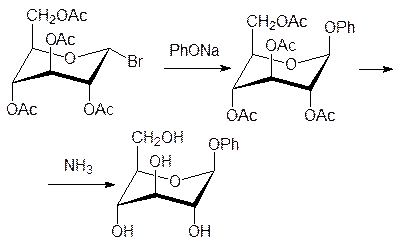
При нагревании глюкозы с уксусным ангидридом в присутствии каталитического коли-чества безводного хлорида цинка образуется пентаацетил-a-глюкоза, а при действии на это соединение раствора бромистого водорода в ледяной уксусной кислоте ацет-оксигруппа аномерного атома углерода заменяется на атом брома:
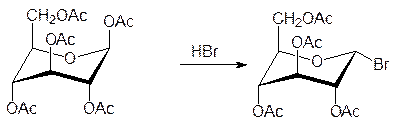
Это соединение, отличающееся высокой реакционной способностью по атому брома, используют для синтеза глюкозидов. Например, фенилглюкозид получают при взаимо-действии этого вещества с фенолятом натрия с последующим снятием ацетильных защитных групп омылением в присутствии оснований (гликозидная связь в этих условиях устойчива) или действием спиртового раствора аммиака:
В качестве защитных групп при синтезе сахаров используются и некоторые кремний-органические соединения. Например, для получения сахарозы, представляющей собой дисахарид, то есть молекулу состоящую из двух сахаров – глюкозы и фруктозы, прово-дили реакцию конденсации тетрабензилглюкозы с S-этилтиофруктозидом, гидроксиль-ная группа которого в 6-положении была защищена диметил-трет.-бутилсилильной группой, в 3-положении бензильной группой, а в 1,4-положениях тетраизопропилди-силоксановой группой
Бензильные группы снимают гидрированием над палладиевым катализатором, а крем-нийорганические группы действием кислот. До этого синтеза, сообщение о котором появилось в конце 2000 года, синтез сахарозы представлялся Эверестом в органи-ческой химии.
И все же для синтеза подавляющего большинства глюкозидов, используют бромид тетраацетилглюкозы. В качестве примеров некоторых природных глюкозидов можно привести арбутин, салицин, синигрин и содержащий два сахарных остатка амигдалин из плодов косточковых:
|
|
|
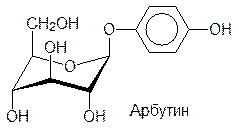

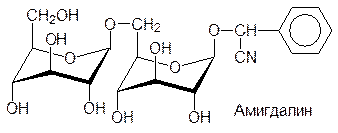

Связанные с сахарами несахаридные фрагменты гликозидов называют агликонами. В соответствии с этим, агликоном арбутина является гидрохинон, агликоном салицина – салициловый спирт, агликоном амигдалина – циангидрин бензальдегида. Синигрин, представляющий собой тиоглюкозид, в присутствии фермента мирозиназы разлагается с образованием аллилизотиоцианата.
Как отмечалось выше, аномерная гидроксильная группа отличается от других повы-шенной реакционной способностью. Она замещается на алкоксигруппы при взаимо-действии со спиртами, а при действии жидкого аммиака идет замещение на амино-группу. Так, например, из арабинозы получают арабинозиламин (N-ацеталь):
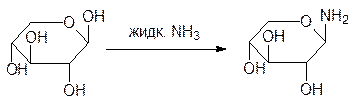
Однако, в живой природе для образования построенных по аналогичной схеме нуклео-зидов из рибозы и входящих в состав нуклеиновых кислот гетероциклов требуется участие аденозинтрифосфата, образующего промежуточные фосфатные производные по аномерной гидроксильной группе. В общем виде эта реакция может быть пред-ставлена схемой образования аденозина из рибозы и аденина:
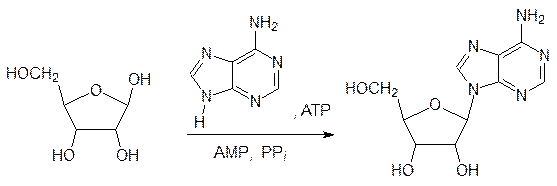
При действии на альдозы меркаптанов очень легко образуются тиоацетали, например

В этом случае конечным продуктом реакции является полный тиоацеталь, что подразу-мевает возможность участия в реакции не полуацетальной, а альдегидной формы глю-козы. Кстати ее содержание в водном растворе глюкозы оценивается в 0,0026 %.
При образовании гликозидных связей между молекулами моносахаридов образуются дисахариды, трисахариды, олигосахариды и полисахариды. Именно эти соединения оправдывают общий вид формулы углеводов Сn(H2О)m, поскольку для моносахаридов n принимает значения от 4 до 8. Самые известные дисахариды – это сахароза, лактоза и мальтоза, а также целлобиоза, образующаяся при частичном гидролизе целлюлозы:

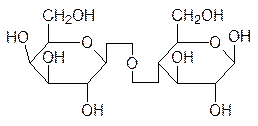
сахароза лактоза
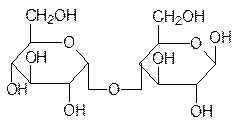
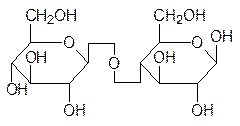
мальтоза целлобиоза
В этом ряду выделяется сахароза, у которой в образовании одной гликозидной связи приняли участие две аномерных гидроксильных группы: из молекулы глюкозы и из молекулы фруктозы. В результате образуется эфирная группа, которая достаточно устойчива к гидролизу. Это означает, что карбонильные группы фрагментов глюкозы и фруктозы не могут проявлять характерные для других сахаров свойства. Сахароза не мутаротирует и не восстанавливает обычные реагенты, используемые для выявления карбонильных групп. Сахароза, в отличие от других производных сахаров, сравнитель-но устойчива к действию ферментных систем многих микроорганизмов. Поэтому рас-тения часто используют ее в качестве запасного углевода. Гидролитическое расщепле-ние сахарозы на глюкозу и фруктозу протекает под действием фермента сахаразы (инвертазы). В организме человека он локализован в стенках тонкого кишечника. Пче-лы с помощью этого фермента переводят сахарозу нектара в мед. Смесь глюкозы и фруктозы (инвертный сахар) плохо кристаллизуется и густая консистенция концентри-рованного раствора этой смеси облегчает использование его пчелами в зимнее время. Название продукта гидролиза сахарозы – инвертный сахар – основано на том, что по мере превращения происходит инверсия (изменение направления вращения плоскости поляризованного света), сахароза вращает вправо, а эквимолярная смесь глюкозы (+53°) и фруктозы (-92°) – влево.
Лактоза – это сахар, который содержится в молоке. Она состоит из молекулы галакто-зы и молекулы глюкозы, причем в образовании гликозидной связи принимает участие b-D-галактоза. Для сохранения привычной формы представления молекул сахаров для таких случаев используются разные способы условного изображения этой связи, один из которых показан на формулах лактозы и целлобиозы. В кишечнике младенцев есть фермент лактаза, который разлагает лактозу на гексозы, но с возрастом его активность ослабевает. Кроме того, у взрослых перестает вырабатываться сычужный фермент, вызывающий коагуляцию казеина. Поэтому многие испытывают неприятные ощуще-ния в пищеварительном тракте от выпитого молока, поскольку оно становится средой для развития гнилостных бактерий.
Соединение в одну молекулу большего числа моносахаридов приводит к образованию три-, тетра- и других олигосахаридов. Два основных полисахарида – это крахмал и его разновидности, а также целлюлоза. Различие между этими продуктами поликонден-сации глюкозы состоит в том, что крахмал, гликоген и другие запасные полисахариды построены из остатков a-глюкопиранозы, а целлюлоза из b-глюкопиранозы. Различие в геометрии гликозидных связей определяет и различие в свойствах этих изомерных полисахаридов. Молекула крахмала сворачивается в спираль, тогда как молекула цел-люлозы стабилизируется водородными связями в линейном виде другими молекулами целлюлозы и образует очень плотно упакованные молекулярные пучки с высокой прочностью взаимного связывания, что и определяет роль этого полисахарида в ка-честве конструкционного элемента клеточных стенок (не путать с мембранами) и внут-реннего скелета растений. Степень поликонденсации целлюлозы зависит от локали-зации ее в растениях. В межклеточной среде, окружающей растительные клетки, содер-жится гемицеллюлоза, ее молекулы включают нескольких сот молекул глюкозы. Цел-люлоза волокон хлопчатника построена из 2-6 тысяч молекул глюкозы, но есть и образцы целлюлозы с более высокими значениями молекулярных масс.
При гидролизе в присутствии кислот в жестких условиях целлюлоза превращается в глюкозу, правда, чистота этой глюкозы недостаточна для использования ее в пищевых целях. Тем не менее она может служить сырьем для получения технического спирта. В мягких условиях разбавленная соляная кислота (1-2,5 н) гидролизует только ирре-гулярные участки в пучках ассоциированных молекул целлюлозы. При этом образуется так называемая микрокристаллическая целлюлоза (МКЦ). В воде она сильно разбухает и поэтому ее используют в пищевой промышленности в качестве загустителя соков и мороженного, а в фармации ее используют в качестве наполнителя и покрытия для таблетированных лекарств. Кроме того, ее можно принимать внутрь для создания эффекта насыщения и выведения из организма токсинов и ионов тяжелых металлов (набухшая МКЦ – это хороший сорбент).
Целлюлозу можно растворить в концентрированном растворе хлорида цинка, в медно-аммиачном растворе, в концентрированной серной кислоте, что используется для получения пергаментной бумаги и искусственного волокна. Вовлеченность гидрок-сильных групп в образование водородных связей определяет способность целлюлозы взаимодействовать с щелочами с образованием солей, которые могут быть использо-ваны для проведения реакций алкилирования. Так, например, действием на натриевое производное целлюлозы метилхлорида получают метилцеллюлозу, которая несмотря на замену части гидрофильных гидроксильных групп на гидрофобные метильные луч-ше растворяется в воде, чем целлюлоза. Другими продуктами такого рода являются гидроксиалкилцеллюлозы и карбоксиметилцеллюлоза, образующаяся при алкилиро-вании ее натриевого производного хлорацетатом натрия. Натриевая соль карбокси-метилцеллюлозы (КМЦ) также широко используется в самых разных областях, вклю-чая фармацевтическую промышленность. Важную роль играют также продукты этери-фикации целлюлозы уксусной и пропионовой кислотой (они растворимы в органичес-ких растворителях), используемые для производства пленок. К сложным эфирам цел-люлозы относится и ксантогенат, образующийся из натриевого производного целлю-лозы и сероуглерода.
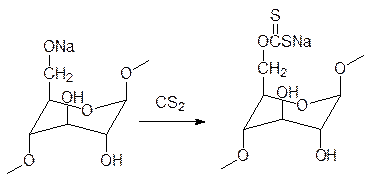
Его вязкий раствор, называемый вискозой, используется для получения искусствен-ного волокна и упаковочных пленок (целлофан). А растворимые в органических рас-творителях эфиры целлюлозы и азотной кислоты служили основой для получения пластмасс (целлулоид), волокон (нитратный шелк) и пленок, но из-за горючести их сейчас используют только для производства пороха.
Кроме реакций конденсации с участием аномерных гидроксильных групп сахара могут также вступать в реакции окисления. При этом могут быть получены три типа кислот. Если в молекуле глюкозы окисляется альдегидная группа, то это приводит к образова-нию глюконовой кислоты, которая в свободном виде превращается в соответствующие лактоны. При недостатке в организме кальция принимают его глюконат. Окисление концевой гидроксильной группы (С6) приводит к глюкуроновой кислоте. Она участ-вует в образовании многих биополимеров. Так, например, содержащийся наряду с гемицеллюлозой в межклеточной среде растений пектин (основа мармелада) представ-ляет собой полиглюкуроновую кислоту, часть карбоксильных групп которой этерифи-цирована метанолом. Дикарбоновая кислота на основе глюкозы называется глюка-ровой. Это достаточно сильная кислота, используемая в фармации для образования солей с субстанциями основного характера.
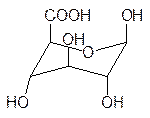
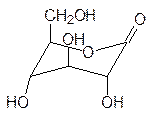
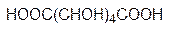
глюконовая кислота глюкуроновая кислота глюкаровая кислота
Важными структурными аналогами гексоз являются аминосахара, у которых одна из гидроксильных групп заменена на аминогруппу, несущую ацильный остаток. Так, по типу целлюлозы из N-ацетилглюкозамина построен хитин – основа панциря членис-тоногих (насекомые, ракообразные).
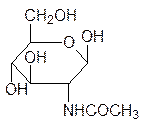
Хитозан – это деацетилированный хитин. Гиалуроновая кислота, содержащаяся в тка-нях кожи, в хрящах, в синовиальной жидкости, играющей роль смазки в суставах, представляет собой сополиконденсат с чередованием фрагментов глюкуроновой кис-лоты и N-ацетилглюкозамина. Гель, структурированный гиалуроновой кислотой, обра-зует стекловидное тело глаза. В нем всего лишь 1 % гиалуроновой кислоты связывает 99 % водной среды.
Особого разговора заслуживает гепарин, состоящий в среднем из восьмидесяти саха-ридных остатков, которые представлены чередующимися молекулами глюкуроновой кислоты, которая сульфатирована по гидроксильной группе у второго атома углерода, и глюкозамина, который сульфатирован по аминогруппе и по концевой гидроксильной группе. Часть остатков глюкуроновой кислоты в гепарине заменена на остатки L-иду-роновой кислоты, это эпимер глюкуроновой кислоты по пятому атому углерода, а у некоторых глюкозаминовых остатков сульфамидная группа может быть заменена ацет-амидной, например это фрагмент формулы
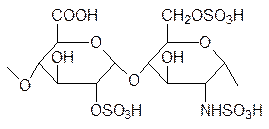
Этот важный биополимер, образующийся в тучных клетках рыхлой соединительной ткани животных, выполняет ряд важных биологических функций. Более всего известна его антикоагулянтная активность, то есть он препятствует свертыванию крови, и по-этому его вводят в состав средств для лечения заболеваний, связанных с тромбо-образованием, но гепарин также участвует в развитии эмбриона, в процессе ангио-генеза (рост новых кровеносных сосудов), в развитии болезни Альцгеймера и в передаче сигналов. Было установлено, что антикоагулянтная активность гепарина сохраняется при сокращении числа сахаридных фрагментов до 10 (пять пар приведен-ной выше структуры). Более того, такие олигосахаридные гепарины оказались более избирательными антикоагулянтами, лишенными некоторых отрицательных побочных эффектов высокомолекулярного гепарина.
Еще одним натуральным антикоагулянтом является растворимый в воде белок гирудин, который выделяет в кровь медицинская пиявка. Гепарин и гирудин различаются по механизмам действия. Гепарин усиливает активность антикоагулянтного фактора крови III, тогда как гирудин блокирует фермент тромбин, участвующий в образовании белка фибрина.
Как лекарственное средство, гирудин по многим показателям превосходит гепарин, поскольку его роль ограничивается только предотвращением тромбообразования. Важ-но также, что в отличие от других белков он не вызывает иммунной реакции. Понятно, что выделение достаточного для лекарственных целей количества гирудина из меди-цинских пиявок не представляется возможным. В связи с этим были проведены опыты по получению генетически модифицированных культур дрожжей и бактерий, которые продуцируют этот белок. Однако, синтез белка в бактериях начинается с аминокислоты метионина, остаток которой добавляется к нативной структуре этого белка и делает его малоактивным, более активный белок синтезируют дрожжи. В то же время небольшой размер этого белка и хорошая растворимость в воде делает его идеальным объектом для экспрессии в системах, основанных на генетически модифицированных раститель-ных клетках. Гирудин очень стабилен и легко определяется с помощью цветных реак-ций, что облегчает проведение аналитических исследований с его участием. Во всяком случае, в арсенале лекарственных средств уже появился препарат лепиридин, который полностью идентичен натуральному гирудину.
Особый интерес среди производных сахаров представляет аскорбиновая кислота – про-тивоцинготный фактор и специфический регулятор многих окислительно-восстанови-тельных реакций. В организмах многих животных, к числу которых относятся, напри-мер морские свинки и приматы, нет биохимических систем, предназначенных для син-теза эндогенной аскорбиновой кислоты. В соответствии с этим аскорбиновая кислота обязательно должно входить в состав пищи. Считается, что для человека оптимальная доза этого вещества равна 30 мг в сутки, хотя в организме крыс, которые не нуждаются во внешнем источнике аскорбиновой кислоты, она образуется в количестве около 7,5 мг, что в пересчете на вес человека соответствует ежедневной дозе примерно в 2000 мг. Аскорбиновая кислота представляет собой циклический лактон, кислотные свойства которого определяются енольной функциональной группой:
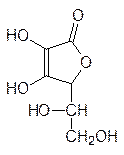
Из представленной формулы следует, что аскорбиновая кислота является продуктом окисления сахара в L-форме. Для ее получения были разработаны многочисленные методики, использующие в качестве исходного продукта глюкозу. При гидрировании глюкозы на нейтральном медно-хромитном катализаторе с выходом до 97 % образуется только сорбит, так как продукты перегруппировки Лобри-де-Брюйна-ван-Экенштейна образуются только в присутствии оснований:

Поворот молекулы сорбита на 180° показывает, что атом углерода, находившийся око-ло карбонильной группы в молекуле глюкозы, имеет L-конфигурацию. Избирательное окисление сорбита химическими способами, при любом подборе защитных групп, не дает высокого выхода продуктов, которые могут быть использованы для получения аскорбиновой кислоты. Поэтому при производстве аскорбиновой кислоты на второй стадии используют биохимическое окисление.
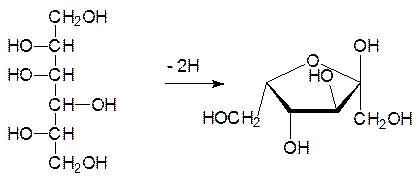
Сорбит содержится в ягодах рябины, где он служит субстратом для бактерии Acetobacter suboxydans. Ферментные системы этой бактерии избирательно дегидрируют сорбит до кетосахара L-сорбозы, которая включается в метаболизм этих бактерий, но не сбраживается дрожжами.
При нагревании L-сорбозы с ацетоном в присутствии кислого катализатора защищают-ся гидроксильные группы (диоксолановый и 1,3-диоксановый циклы):
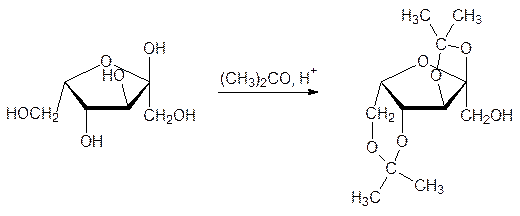
Теперь в щелочной среде можно окислить свободную гидроксиметильную группу и после снятия защитных изопропилиденовых групп получить кетокислоту, для перевода которой в аскорбиновую кислоту ее сначала этерифицируют, затем обрабатывают метилатом натрия и подкисляют:

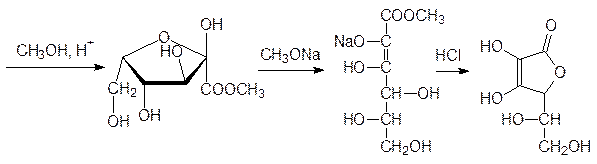
Отсутствие в рационе аскорбиновой кислоты с такими серьезными последствиями, как цинга, сегодня практически не встречается, но ее недостаток приводит к снижению сопротивляемости организма по отношению, например, к вирусным инфекциям, к экстремальным нагрузкам и стрессам.
|
|
|
|
|
Дата добавления: 2015-07-13; Просмотров: 4541; Нарушение авторских прав?; Мы поможем в написании вашей работы!