
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Восстановление примесей
|
|
|
|
Восстановительная очистка применяется в тех случаях, когда СВ содержат легко восстанавливаемые вещества. Эти методы используют для удаления из СВ соединений ртути, хрома (VI), мышьяка.
Ртуть. В процессе очистки неорганические соединения ртути восстанавливают до металлической ртути с последующим отделением отстаиванием, фильтрованием или флотацией. Органические соединения ртути сначала окисляют с разрушением соединений, затем катионы ртути восстанавливают до металла. Для восстановления ртути применяют сульфид железа, бисульфит натрия, гидразин, порошки железа, алюминия, сероводород.
Мышьяк в СВ содержится в виден кислородсодержащих молекул, анионов и в виде анионов тиосолей AsS2-, AsS3-3. При больших концентрациях мышьяка (до 110 г/л) метод очистки состоит в восстановлении мышьяковой кислоты до мышьяковистой диоксидом серы.
Мышьяковистая кислота малорастворима и осаждается в виде триоксида мышьяка.
Хром. Очистка СВ от Сr(VI) основана на восстановлении его до Cr(III) с последующим осаждением в виде гидроксида в щелочной среде. В качестве восстановителей используют АУ, катионы Fe(II), бисульфат натрия, SO2, отходы органических веществ (н-р, газетная бумага, древесные отходы):
4H2CrO4 + 6NaHSO3 + 3H2SO4 = 2Cr2(SO4)3 + 3Na2SO4 + 10H2O
Реакция проходит быстро при рН 3-4 в избытке серной кислоты.
Нейтрализация СВ и осаждение ионов металлов
По составу СВ промышленности делят на три основные группы:
Ø -циансодержащие (содержат высокотоксичные соединения синильной кислоты),
Ø -хромсодержащие (содержат высокотоксичные соединения Сr+6),
Ø -кислотно-щелочные (содержат свободные минеральные кислоты и щелочи, соли тяжелых металлов, щелочных металлов и аммония, органические соединения и др.).
|
|
|
При наличии на предприятии большого количества фторсодержащих СВ их иногда выделяют в отдельный поток. Отдельным потоком могут быть выделены нефте-и маслосодержащие СВ.
СВ указанных групп должны отводиться от мест образования по отдельным системам канализации и обрабатываться на отдельных (локальных) установках. После реагентного обезвреживания СВ первой и второй групп возможно их объединение со СВ третьей группы для совместной нейтрализации и удаления ионов тяжелых металлов (ИТМ).
Совместное отведение циансодержащих и кислотно-щелочных или хромсодержащих СВ недопустимо из-за возможности образования и выделения циановодорода. При совместном отведении и обезвреживании хромсодержащих и кислотно-щелочных СВ неизбежен значительный перерасход реагентов.
По действующим нормативам сбросу в систему канализации и в водные объекты подлежат СВ с рН 6,5 - 8,5. Если СВ имеет кислый (рН < 6,5) или щелочной (рН > 8,5) характер, она подлежит нейтрализации, т.е. уменьшению содержания Н+ или ОН- ионов.
Высокое содержание Н+ ионов обусловлено присутствием в СВ свободных сильных минеральных кислот (серной, соляной, азотной и их смесями), реже - слабых: азотистой, фосфорной, сернистой, сероводородной, плавиковой (фтороводородной), хромовой и органических: уксусной, пикриновой, салициловой.
Высокие концентрации ОН– обусловлены избытком свободных щелочей (гидроксидов Nа, К и щелочноземельных металлов).
С целью предупреждения коррозии материалов канализационных, очистных сооружений, нарушения биохимических процессов на станциях биологической очистки (СБО) и водоемах, для осаждения ионов тяжелых металлов кислые и щелочные СВ подвергают нейтрализации.
Реакция нейтрализации - это химическая реакция между веществами, имеющими свойства кислоты и гидроксида, которая приводит к потере характерных свойств обоих соединений. В результате такой реакции концентрация Н+ и ОН– становится равной 10-7, а рН такой системы становится равным 7.
|
|
|
При химической очистке применяют следующие способы нейтрализации:
Ø -взаимная нейтрализация кислых и щелочных СВ,
Ø -нейтрализация реагентами,
Ø -фильтрование через нейтрализующие материалы.
В последнее время предложен способ нейтрализации щелочных СВ дымовыми газами, что позволяет одновременно с нейтрализацией СВ произвести утилизацию кислотных компонентов газов.
Взаимная нейтрализация кислых и щелочных СВ: как правило, расходы кислых и щелочных СВ различны, поэтому при проведении такого типа нейтрализации необходимо сбалансировать потоки, поступающие на нейтрализацию.
Реагентная нейтрализация СВ применяется при наличии на предприятии одного типа СВ. Наиболее широко ее используют при нейтрализации кислых СВ.
Реагенты, применяемые для нейтрализации СВ.
Аммиак - газ, характеризующийся высокой растворимостью, быстро вступает в реакцию и образует растворимые продукты реакции. Выброс аммиака в атмосферу строго ограничен, его применяют для нейтрализации лишь когда целесообразно выделение в качестве побочного продукта аммонийной соли. Аммиак можно хранить и использовать в газообразном, жидком состоянии или в виде раствора.
Карбонат натрия (сода) - растворимое вещество с высокой реакционной способностью.
Гидроксид натрия (каустическая сода) - щелочь с высокой реакционной способностью, гигроскопична.
Известь. Такое название применяется для обожженного известняка (негашеной извести) - СаО и его гидрата - гашеной извести - Са(ОН)2. В основном используются два типа известняка - кальциевый и доломитовый. Известняк с высоким содержанием кальция состоит, в основном, из СаСО3 с небольшим содержанием МgСО3. В состав доломитовых известняков входят примерно одинаковые мольные количества СаСО3 и МgСО3. Основными примесями, содержащимися в известняке в количестве до 5%, являются кремнезем (SiO2), глинозем (Al2О3) и соединения железа.
Негашеная известь характеризуется сродством к СО2 и Н2О. При нарушении условий хранения или транспортировки она "гасится" на воздухе, поглощая эти вещества из воздуха и переходя в карбонат, что приводит к набуханию продукта и резкому снижению химической активности. Для достижения максимальной эффективности производят гашение негашеной извести (гидратирование) с получением суспензии, которую смешивают с водой до содержания 10 - 35% извести (в расчете на сухое вещество) и направляют в реакционные аппараты. При хранении эта суспензия реагирует с СО2 воздуха и теряет химическую активность, поэтому ее готовят перед использованием.
|
|
|
Гашеная известь более устойчива, чем негашеная, но все вышесказанное относится и к ней.
Извести - наиболее дешевые реагенты для проведения процессов нейтрализации.
Диоксид углерода содержится в отходящих газах сжигания органического топлива, такие газы можно использовать для нейтрализации щелочных растворов. При растворении СО2 снижается рН раствора, поэтому трубопроводы для таких жидкостей необходимо изготавливать из коррозионностойких материалов.
Диоксид серы - газообразный восстановитель и кислотный реагент.
Серная кислота - техническая применяется для снижения щелочных рН.
Соду и щелочи следует использовать, если они являются отходами производства. При нейтрализации применяют и другие отходы производства, н-р, шлаки сталеплавильного и доменного производств используют при нейтрализации СВ, содержащих серную кислоту.
Различают три вида кислотсодержащих СВ:
Ø СВ, содержащие слабые кислоты (н-р, угольную, уксусную),
Ø СВ, содержащие сильные кислоты (н-р, соляную, азотную). Для их нейтрализации м.б.использован любой вышеназванный реагент,
Ø СВ, содержащие серную и сернистую кислоты. Кальциевые соли этих кислот плохо растворимы и выпадают в осадок.
Выбор реагентов обусловлен технологическими и экономическими требованиями: реагенты выбирают в зависимости от состава и концентрации примесей СВ. При этом учитывают, будет ли в процессе нейтрализации образовываться осадок. Если при использовании каждого из двух реагентов будет достигаться качество обработки, соответствующее требованиям, то предпочтительнее использовать реагент, который имеет меньшую стоимость, позволяет использовать более дешевое и надежное оборудование, а также обеспечивает упрощение на стадии транспортировки и удаления образующихся шламов.
|
|
|
Принципиальная схема станции реагентной нейтрализации:
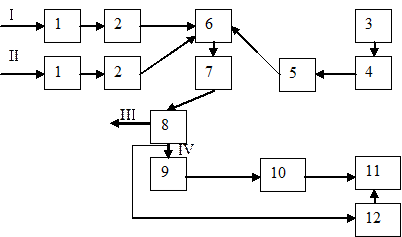
I, II - подача соответственно кислых и щелочных СВ;
III, IV - выпуск соответственно нейтрализованных СВ и осадка;
1 - песколовки,
2 - усреднители,
3 - склад реагентов,
4 - растворные баки,
5 - дозатор,
6 - смеситель,
7 - нейтрализатор,
8 - отстойник,
9 - осадкоуплотнитель,
10 - вакуум-фильтр,
11 - накопитель обезвоженных осадков,
12 - шламовые площадки.
Нейтрализация фильтрованием кислых СВ через нейтрализующие материалы проводится с использованием в качестве фильтрующего материала магнезита, доломита, известняка, мела, мрамора, твердых щелочных отходов (шлак, зола). Процесс ведут в фильтрах-нейтрализаторах (горизонтальных или вертикальных). Применение таких фильтров возможно при отсутствии в кислых СВ ионов металлов, т.к. при рН больше 7 они выпадают в осадок в воде труднорастворимых соединений, забивающих поры фильтра. Концентрация серной кислоты в СВ ограничивается 1,5 г/л, т.к. при больших концентрациях количество образующегося сульфата кальция превышает его растворимость (около 2 г/л). Выпадающий осадок покрывает поверхность нейтрализующего материала и нейтрализация прекращается. Если загрузка выполнена из карбоната магния, концентрационные ограничения снимаются, т.к. растворимость сульфата магния достаточно высока (355 г/л по MgSO4).
Нейтрализация кислыми газами используется для нейтрализации щелочных СВ, что позволяет одновременно с процессом обезвреживания жидкой фазы проводить высокоэффективную очистку газов от вредных компонентов. Использование в качестве нейтрализующего вещества СО2 имеет ряд преимуществ по сравнению с серной или соляной кислотами. Применение СО2 дымовых газов позволяет резко снизить стоимость процесса нейтрализации, плохая растворимость СО2 снижает опасность перекисления СВ, образующиеся карбонаты находят применение в промышленности, коррозионные и токсичные действия карбонат-ионов меньше, чем сульфат- и хлорид-ионов.
Как правило, кислые СВ, образовавшиеся в процессах обработки металлов, содержат ионы железа и ИТМ в концентрациях, часто намного превышающих концентрации свободных кислот. В этих случаях нейтрализация сопровождается реакциями химического осаждения металлов в виде труднорастворимых гидроксидов. При нейтрализации кислых СВ реагенты расходуются как на снижение концентрации в них Н+- ионов, так и на образование гидроксидов тяжелых металлов.
Значения рН, соответствующих началу и окончанию осаждения гидроксидов тяжелых металлов в водных растворах приведены в табл.
Величины рН осаждения гидроксидов металлов
| Катион | Начало осаждения при исходной концентрации ИТМ | Полное осаждение |
| железо(+2) | 7,5 | 9,7 |
| железо(+3) | 2,3 | 4,1 |
| цинк(+2) | 6,4 | 8,0 |
| хром(+3) | 4,9 | 6,8 |
| никель(+2) | 7,7 | 9,5 |
| алюминий(+3) | 4,0 | 5,2 |
| кадмий(+2) | 8,2 | 9,7 |
| свинец(+2) | 7,8 | 9,3 |
Нужно помнить об амфотерности ряда соединений: при рН 10,5 начинается растворение гидроксидов, при рН 12 осадка уже нет, поэтому осаждение необходимо вести при рН 8-9.
Лучший вариант осаждения - использование “недожженной” извести, т.к. в ней остаются ионы СО3-2. При рН > 7 эффект очистки усиливается за счет образования основных карбонатов, имеющих меньшую растворимость, чем гидроксиды.
Обработка СВ щелочными реагентами позволяет снизить содержание ИТМ до величин, позволяющих сбросить СВ в систему канализации для дальнейшего обезвреживания. Однако, в тех случаях, когда требуется более глубокая очистка СВ, использование только щелочного реагента не всегда дает необходимый результат.
Более глубокая очистка достигается при использовании сульфидов для осаждения ИТМ в сульфидной форме. Сульфиды осаждаются при различных рН, н-р, наименее растворимые сульфиды свинца, кадмия и цинка осаждаются даже в кислой среде. Все сульфиды склонны к образованию коллоидных растворов.
Если нейтрализация предшествует доочистке СВ сульфидом натрия, то сначала отделяют отстаиванием осадок гидроксидов металлов, а затем добавляют сульфид в стехиометрически необходимом количестве.
ПР сульфидов гидроксидов
Сu+2 8,5·10-45 5,1·10-2
Ni+2 1,4·10-24 2·10-15
Zn+2 1,6·10-24 7,1·10-18
Рb+2 3,4·10-28 1,1·10-20
Нg+2 1,6·10-52 остаточная С(Нg+2)=2,5·10-21мг/л
Схема полной реагентной очистки СВ от ИТМ
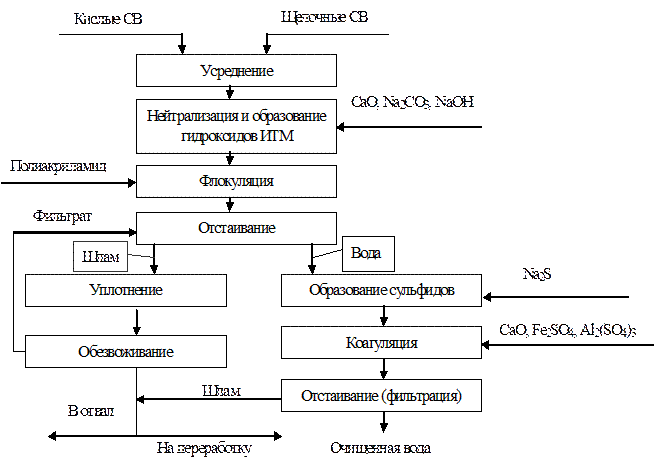
Осаждение примесей может проводиться как в периодическом, так и в непрерывном режиме. Преимущество периодического режима - возможность тщательного контроля и более высокое качество обработки; недостаток - необходимость использования больших производственных площадей. Время пребывания в реакторах, как правило, составляет 3-10 мин в реакторах с перемешиванием и 5-15 мин в реакторах, где осуществляется флокуляция.
Для повышения производительности осаждения часто приходится добавлять флокулянты.
Во многих случаях при осуществлении процесса достигается производительность, превышающая теоретически рассчитанную. Это происходит из-за процесса соосаждения, при выпадении большого количества хлопьеобразного осадка, содержащего соединения Fе и Аl (гидролизующиеся катионы).
Наиболее часто встречаются кислые СВ процесса травления. В качестве травильных растворов применяются серная, соляная кислоты и их смеси. Для травления специальных марок сталей используют азотную, фосфорную и плавиковую кислоты. При травлении железа серной кислотой основным продуктом травления является сульфат железа, который с серной кислотой составляет основную часть загрязнений, растворенных в СВ. Окалина, песок и другие твердые частицы составляют нерастворимую часть загрязнений. Многократно использованные травильные растворы обогащаются солями железа и выводятся из производства. Отработанные травильные растворы обрабатываются на купоросных установках, где регенерируется серная кислота и извлекается железный купорос. Из других травильных растворов извлекается хлорид железа или электролитическое железо. Отработанные растворы содержат 30-70 г/л серной кислоты и до 300 г/л сульфата железа. Промывные воды содержат до 5 г/л кислоты, до 8 г/л солей железа. Попадание отработанных растворов в промывные воды усложняет обработку, создавая неравномерность концентрации загрязнений.
|
|
|
|
|
Дата добавления: 2015-07-13; Просмотров: 504; Нарушение авторских прав?; Мы поможем в написании вашей работы!