
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Каждая мутация, затрагивающая цикл деления дрожжевой клетки, останавливает или нарушает ход этого
13-10
13-7
13.1.7. Митоз запускается «М-стимулирующим фактором» (MPF) [4,7]
Исчезновение сигналов, задерживающих М-фазу, само по себе еще не достаточно для запуска митоза - для этого нужен еще один цитоплазматический фактор. Нормальную фазу G2 можно рассматривать как период подготовки к выработке этого решающего фактора, включающего механизм митоза после исчезновения факторов задержки. Данные об этом тоже получены в экспериментах со слиянием клеток.
Когда клетка в М-фазе сливается с клеткой в любой из стадий интерфазы (С1, S или G2), интерфазное ядро быстро вступает в М-фазу, осуществляя конденсацию хромосом и готовясь к делению, даже если это грозит (как в случае ядер в фазе G1 или S) нарушить весь дальнейший ход деления (рис. 13-9, й и 13-10). По-видимому, цитоплазма в М-фазе содержит сильный М-стимулирующий фактор (M-phase-promoting factor, MPF), на который ядро реагирует в любой фазе клеточного цикла. Вероятно, только что упоминавшиеся факторы, задерживающие митоз, тормозят выработку MPF, но не могут блокировать его действия, если он уже образовался.
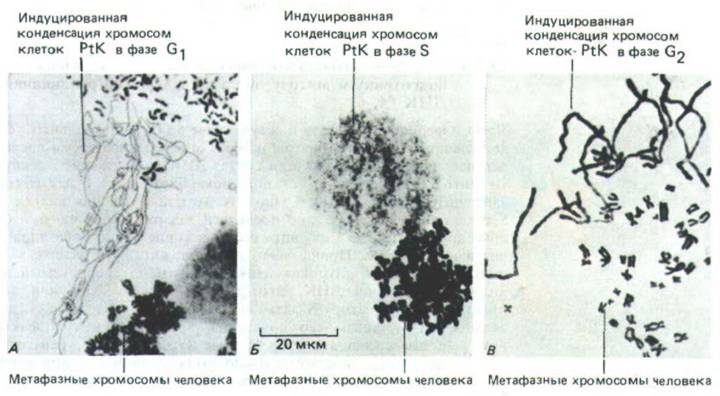
Рис. 13-10. Преждевременная конденсация интерфазных хромосом после слияния интерфазных клеток сумчатого PtK с митотическими клетками человека. А. Клетка PtK была в фазе С1, поэтому ее преждевременно конденсированные хромосомы представлены одиночными хроматидами. Б. Клетка PtK была в фазе S, и теперь ее хроматин приобретает «распыленный» вид. В. Клетка PtK находилась в фазе G2, и теперь хроматиды, хотя и очень длинные по сравнению с нормальными метафазными хромосомами человека, удвоены. (К. Sperling, P. Rao, Humangenetik 23: 235-258, 1974.)
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
13.1.8. События хромосомного цикла - связанные между собой звенья одной цепи [8]
Описанные выше эксперименты могут служить основой для функциональной классификации некоторых молекул, видимо, управляющих событиями хромосомного цикла. Были описаны три контролирующих фактора, способных к диффузии; для краткости удобно будет считать, что каждый из них представляет собой одну молекулу, хотя на самом деле они могут быть более сложными. Это 1) активатор S-фазы, который в норме присутствует в цитоплазме клеток только в S-фазе и включает синтез ДНК; 2) М-стимулирующий фактор (MPF), который содержится в цитоплазме только в М-фазе и вызывает конденсацию хромосом; 3) ДНК-зависимый М-задерживающий фактор (M-phase-delaying factor, возможно, идентичный активатору S-фазы), который присутствует в цитоплазме в S-фазе и ингибирует процессы, ведущие к выработке MPF.
Моменты быстрого появления и исчезновения этих диффундирующих факторов в цитоплазме разграничивают ряд событий клеточного цикла, и промежутки времени между ними определяют протяженность всего цикла.
Причинные зависимости между тремя факторами (а возможно, и другими, еще не известными) гарантируют, что события хромосомного цикла всегда будут проходить в определенной последовательности, предотвращая такие гибельные неувязки, как конденсацию хромосом посреди фазы синтеза ДНК. Каждый последующий шаг зависит от предыдущего. Поэтому клетка не может вступить в митоз, пока не появится М-
стимулирующий фактор; а он не может появиться, пока не исчезнет М-задерживающий фактор; М-задерживающий фактор и активатор S-фазы не смогут исчезнуть до окончания синтеза ДНК; синтез ДНК не прекратится до репликации всей ДНК; следующая репликация ДНК не может начаться до снятия блокады повторной репликации при переходе в G1. Позже мы встретим еще один пример: клетка не может перейти из митоза в G1, пока хромосомы не распределятся с помощью митотического веретена (разд. 13.5.7). Все эти наблюдения, а также те, которые будут рассматриваться позже (разд. 18.2.1, 19.8.2), указывают на то, что большинство событий и процессов хромосомного цикла взаимосвязаны, образуя зависимую последовательность.
13.1.9. Во время ранних делений дробления, когда клетки не растут, клеточный цикл бывает укорочен [9]
Для изучения молекул, управляющих хромосомным циклом, особенно полезными оказались эксперименты с яйцами и ранними зародышами шпорцевой лягушки Xenopus. Яйцо Xenopus, как и у многих других видов, представляет собой необычайно крупную сферическую клетку. Ее диаметр составляет чуть больше миллиметра, и она содержит запас практически всех веществ (за исключением ДНК), необходимых для построения раннего эмбриона. Все эти вещества запасаются в течение долгого периода роста незрелого яйца, называемого ооцитом. Эту длительную стадию лучше всего определить как фазу G2 первого цикла мейотического деления (хотя обычно ее называют профазой первого деления мейоза, она во многих отношениях напоминает обычную фазу G2-см. разд. 15.2.7). Во время овуляции воздействие гормонов приводит к созреванию яйца, так что к моменту откладки оно успевает уже пройти последующие стадии мейоза и останавливается в М-фазе второго мейотического деления (разд. 15.3.3). Затем оплодотворение запускает чрезвычайно быструю последовательность клеточных делений:
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.

Рис. 13-11. Примерно за 7 ч в яйце Xenopus проходит 12 очень быстрых синхронных циклов деления, состоящих из чередующихся фаз S и М без заметных фаз G1 и G2. Эти деления дробят яйцо на 4096 (212) более мелких клеток. На каждой стадии цветом выделена одна клетка.
одна гигантская клетка дробится, образуя зародыш, состоящий из тысяч мелких клеток (рис. 13-11). При этом роста практически не происходит -
из макромолекул синтезируется только ДНК, необходимая для образования нужного числа ядер, и немного белка. После первого деления, длящегося около 90 мин, последующие 11 делений проходят более или менее синхронно с 30-минутными интервалами, и в результате примерно за 7 ч образуется 4096 (212) клеток. Предварительное накопление веществ в яйце делает возможными столь быстрые клеточные циклы благодаря тому, что исключается время, необходимое для роста клеток во время каждого цикла. Циклы репликации ДНК и деления укорачиваются за счет того, что фазы S и М ускоряются, a Gl и G2 становятся такими короткими, что практически неразличимы.
13.1.10. М-стимулирующий фактор (MPF) вызывает митоз у самых разнообразных клеток [10]
Поскольку ооциты и яйца шпорцевой лягушки очень крупны, в их цитоплазму легко инъецировать различные вещества. Кроме того, ооцит, яйцо и ранний зародыш служат обильными источниками цитоплазмы строго определенных стадий клеточного цикла. Это особенно важно при изучении М-стимулирующего фактора (MPF, или МСФ), о котором говорилось выше. Этот фактор был впервые открыт в зрелых неоплодотворенных яйцах Xenopus, которые находятся в М-фазе. Если цитоплазму из такого яйца инъецировать в ооцит, она выводит его из стадии G2 и заставляет перейти в М-фазу. Тем самым начинается созревание ооцита (первоначально сокращение MPF означало mutaration promoting factor-
«фактор, способствующий созреванию»; см. разд. 15.3.6). Активный MPF появляется также в дробящемся яйце (зародыше) во время каждой М-
фазы (рис. 13-12). Таким образом, яйцо и ооцит Хепорш могут служить как источником материала при попытках получить очищенный MPF, так и объектом для определения его активности (рис. 13-13).

Рис. 13-12. Уровни активности М-стимулирующего фактора (MPF, или МСФ) в ооците, яйце и раннем зародыше Xenopus. Ооцит останавливается в фазе G2 мейоза при низком уровне MPF; зрелое отложенное яйцо останавливается в фазе М мейоза при высоком уровне MPF;
после оплодотворения ранний эмбрион проходит чередующиеся фазы S и М при соответственно меняющихся уровнях активности MPF.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.

Рис. 13-13. Пробы на MPF путем инъекции в оопит Xenopus. Присутствие MPF выявляется благодаря его способности переводить ооцит в фазу М. Крупное ядро («зародышевый пузырек») ооцита разрушается во время образования митотического веретена.
MPF имеет универсальное значение для эукариотических клеток и в эволюции высококонсервативен: экстракты, приготовленные из митотических клеток весьма разнообразных организмов, таких как млекопитающие, морские ежи, моллюски и дрожжи, при введении в ооциты Xenopus переводят их в М-фазу. Из зрелых яиц Xenopus был получен очищенный препарат с активностью MPF. Он ведет себя как крупный белок, состоящий из субъединиц двух типов; одна из таких субъединиц - протеинкиназа, и она, по-видимому, способна фосфорилировать другую. Поэтому MPF, вероятно, может активировать сам себя: если небольшое количество препарата с активностью MPF инъецировать в ооцит Xenopus, клетка отвечает образованием намного большего количества MPF из своих собственных неактивных резервов (разд. 15.3.6). Эти и другие данные позволяют предполагать, что появление и исчезновение активности MPF на протяжении нормального клеточного цикла зависит от модификации белка - от его фосфорилирования и дефосфорилирования, а не от синтеза и распада. Однако для нормального «запуска» активности MPF требуется синтез другого белка, называемого циклином (см. ниже); поэтому клетки всех типов неспособны перейти от интерфазы к М-фазе, когда белковый синтез у них блокирован.
По-видимому, многие из молекулярных изменений, происходящих в митозе, осуществляются путем фосфорилирования; MPF-киназа прямо фосфорилирует некоторые субстраты, в частности такие, как гистон H1, что, возможно, способствует конденсации хромосом (разд. 9.2.2);
может быть, весь комплекс событий, связанных с митозом, MPF запускает с помощью каскада реакций фосфорилирования.
13.1.11. MPF генерируется цитоплазматическим осциллятором [8, 10, 11]
Резкое увеличение количества MPF, происходящее каждые 30 мин в зародыше Хепорш во время дробления, вызывается цитоплазматичес-
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.

Рис. 13-14. Метод выявления колебательного процесса в цитоплазме, связанного с циклом клеточного деления в дробящемся яйце Хепоpus. Только что оплодотворенное яйцо перетягивают на две части петлей из тонкого человеческого волоса; одна половина содержит ядро и продолжает делиться, а другая, лишенная ядра, не делится. Результаты фотосъемки показывают, что безъядерная половина периодически изменяет свои размеры за счет изменений жесткости клеточного кортекса. Эти колебания происходят строго синхронно с делениями в другой половине. (К.
Нага, P. Tydeman, M. Kirschner, Ргос. Natl. Acad. Sci USA 77: 462-466, 1980.)
ким осциллятором, который действует даже в отсутствие ядра. Перетянув активированное яйцо тонким волосом до первого деления, можно разделить его на две примерно равные части, одна из которых содержит ядро, а другая - нет (рис. 13-14). Часть с ядром будет продолжать нормальное дробление. Примечательно то, что и в безъядерной части будет происходить серия осцилляции, выражающихся в повторных циклах легкого периодического сокращения и увеличения жесткости кортикальной цитоплазмы. Эти периодические «спазмы» происходят почти в точности синхронно с делениями дробления другой половины яйца, содержащей ядра. Беря пробы цитоплазмы из осциллирующей безъядерной клетки и испытывая их активность путем инъекции в ооциты, можно показать, что видимые осцилляции сопровождаются (и возможно, вызываются) колебаниями концентрации активного MPF.
Эти и другие эксперименты позволяют предположить, что деления дробления в раннем эмбрионе Хепорus включают два параллельных циклических процесса - цикл репликации хромосом и цитоплазматический цикл MPF, которые в норме координированы между собой, так как каждый новый хромосомный цикл может начаться только тогда, когда блокада репликации ДНК будет снята очередным импульсом МРF в М-фазе.
Такое взаимодействие между двумя циклами предотвращает возможность того, что хромосомный цикл «забежит вперед»; и оно будет поддерживать согласованное протекание обоих циклов до тех пор, пока нет опасности, что слишком медленный хромосомный цикл не обеспечит полную репликацию ДНК до подъема уровня MPF. В яице Хепорus с его необычайно быстрыми S-фазами и регулярными циклами деления такая опасность, по-видимому, мала и простое взаимодействие между циклами кажется достаточным. Однако в клетках млекопитающих, о которых говорилось ранее (и, возможно, в большинстве эукариотических клеток, исключая дробящиеся яйца), есть еще дополнительный механизм: как мы видели, нереплицированная ДНК порождает сигнал задержки М-фазы, который не позволяет цитоплазматическому циклу MPF совершаться быстрее хромосомного цикла. Эксперименты с блокадой репликации ДНК ингибиторами показывают, что в клеточных циклах раннего зародыша Xenopus этот дополнительный контроль не работает. Кроме того, судя по редукции фазы G1, акгиватор S-фазы, по-видимому, присутствует здесь все время. Таким образом, в раннем зародыше Xenopus клеточный цикл упрощен и сжат во времени.
Только что описанные явления означают, что цитоплазматический осциллятор, возможно, имеется во всех клетках, но они ничего не говорят о его механизме. Разгадка могла бы быть связана с другим белком - циклином, который был обнаружен в дробящихся яйцах Хепоpus, морских ежей и двустворчатых моллюсков. Циклин, подобно MPF, принадлежит к небольшой трупе белков, активность которых существенно зависит от фазы клеточного цикла. Хотя циклин синтезируется
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
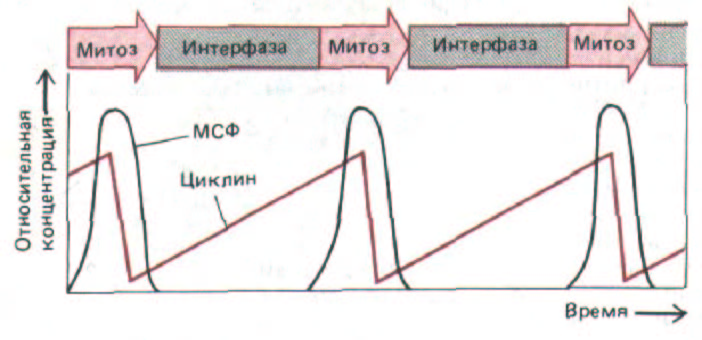
Рис. 13-15. Согласованные подъемы и спады уровней MPF и циклина, связанные с клеточными циклами. Измерения концентрации циклина проводились в основном на яйцах морских беспозвоночных, где циклин составляет 5% белков, синтезируемых во время короткой инкубации с радиоактивными аминокислотами.
с большой постоянной скоростью на протяжении всего цикла, он внезапно распадается в середине М-фазы. Поэтому в каждом цикле его концентрация постепенно возрастает от нуля, а затем резко падает опять до нуля. Гены циклина были клонированы, что позволило приготовить чистую мРНК для этого белка. Когда такую РНК вводят в ооцит Xenopus, это оказывает такое же действие, как и инъекция MPF, переводящее ооцит из G2 в фазу М. Такого рода данные привели к предположению, что подъем MPF в М-фазе вызывается повышением концентрации циклина до некоторого порогового уровня, а разрушение циклина связано с каким-то событием в М-фазе; последующее исчезновение MPF может быть следствием разрушения циклина (рис. 13-15). В таком случае интервал между двумя митозами определялся бы главным образом временем, необходимым для того, чтобы концентрация циклина поднялась от нуля до пороговой величины; при этом клеточный цикл должен был бы останавливаться в интерфазе под действием ингибиторов белкового синтеза, что фактически и наблюдается.
Заключение
Репродуктивный цикл типичной эукариотической клетки можно подразделить на четыре фазы, обозначаемые Gl (от конца митоза до
начала синтеза ДНК), S (синтез ДНК), G2 (от конца синтеза ДНК до начала митоза) и М (митоз). Каждая S- и М-фаза инициируется
растворимым цитоплазматическим фактором [активатором S-фазы и М-стимулирующим фактором (MPF) соответственно]. Активатор S-
фазы образуется на протяжении всей S-фазы и может также действовать как фактор, задерживающий подготовку к М-фазе до тех пор, пока
не завершится репликация ДНК. М-стимулирующий фактор может быть обнаружен в М-фазных клетках многих организмов - от дрожжей до
млекопитающих, и его активность, возможно, регулируется фосфорилированием. В яйцах, быстро подвергающихся дроблению, таких как у
Xenopus, клеточный цикл укорочен и упрощен. В этом случае цикл, по-видимому, регулируется взаимосвязанными колебаниями активности MPF и
концентрации циклина.
13.2. Дрожжи как модельная система [12]
Дрожжи являются одноклеточными грибами и составляют большую группу довольно разнородных организмов. Поскольку они размножаются почти так же быстро, как бактерии, и размеры их генома меньше 1/1000 генома млекопитающих, они оказались чрезвычайно полезными для генетического анализа клеточной биологии эукариот. Хотя яйца Xenopus- исключительно ценный объект для изучения биохимических и цитофизиологических аспектов регуляции клеточного цикла, для генетических исследований этот объект неудобен. Напротив, работа с дрож-
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.

Рис. 13-16. Сравнение клеточных циклов делящихся и почкующихся дрожжей. У делящихся дрожжей (вверху) типичный цикл эукариотической клетки с фазами G1, S, G2 и М. Ядерная оболочка, однако, не разрушается: микротрубочки митотического веретена образуются внутри ядра и прикреплены к полюсным тельцам веретена на его периферии. Клетка делится надвое путем образования перегородки (называемой клеточной пластинкой). У почкующихся дрожжей цикл включает нормальные фазы G1 и S, однако состоящее из микротрубочек веретено начинает формироваться очень рано, во время фазы S, и поэтому нормальная фаза G2 отсутствует. В отличие от цикла делящихся дрожжей здесь во время митоза не происходит видимой конденсации хромосом и клетка делится путем почкования. Как и у делящихся дрожжей (но в отличие от клеток высших эукариот), ядерная оболочка во время митоза сохраняется.
жами открывает широкие возможности для идентификации, клонирования и описания генов, участвующих в контроле клеточного цикла. Мы будем здесь говорить о двух видах: о почкующихся дрожжах Saccharomyces cerevisiae, используемых пекарями и пивоварами, и делящихся дрожжах Schizosaccharomyces pombe. Клетки этих последних делятся симметрично на две одинаковые дочерние клетки, а у почкующихся дрожжей они делятся менее распространенным несимметричным образом: материнская клетка производит маленькую почку, которая растет и проходит оставшиеся фазы цикла, прежде чем окончательно отделиться от родительской клетки (рис. 13-16).
Как полагают, эволюционные ветви, приведшие к почкующимся и к делящимся дрожжам, дивергировали сотни миллионов лет назад.
Тем не менее жизненные циклы у тех и других сходны. Обе формы могут размножаться либо в диплоидном, либо в гаплоидном состоянии.
Диплоидные клетки помимо деления обычным путем способны проходить через мейоз, образуя гаплоидные клетки (см. гл. 15); а гаплоидные клетки наряду с обычным делением могут попарно сливаться между
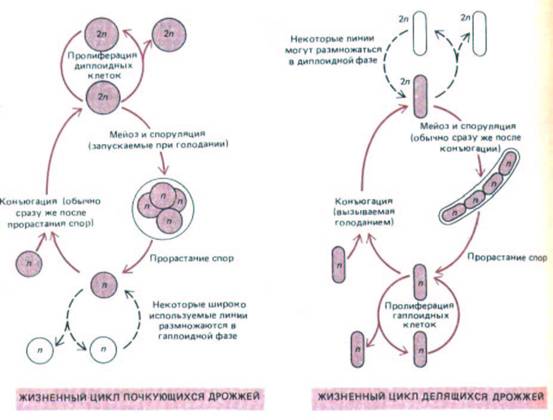
Рис. 13-17. Жизненные циклы почкующихся дрожжей (Saccharomyces cerevisiae) и делящихся дрожжей (Schizosaccharomyces pombe).
Доли жизненного цикла, проводимые в гаплоидной и в диплоидной фазе, меняются от вида к виду и в зависимости от условий среды. При обилии пищи нормальные разновидности дикого типа почкующихся дрожжей размножаются как диплоидные клетки с продолжительностью жизненного цикла около двух часов. При голодании же они претерпевают мейоз с образованием гаплоидных спор, которые в благоприятных условиях прорастают, превращаясь в гаплоидные клетки. Эти клетки в зависимости от условий среды и генотипа либо делятся, либо сливаются (конъюгируют) в фазе G1, вновь образуя диплоидные клетки. Наоборот, делящиеся дрожжи обычно размножаются в гаплоидном состоянии; при недостатке пищи гаплоидные клетки сливаются с образованием диплоидных клеток, которые быстро проходят мейоз и споруляцию с восстановлением гаплоидной фазы. Наиболее широко используемые лабораторные штаммы почкующихся дрожжей - это мутанты, которые, подобно делящимся дрожжам, размножаются главным образом в гаплоидной фазе.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
собой с образованием диплоидных клеток (рис. 13-17; см. также разд. 10.3.2). Наличие гаплоидной фазы облегчает генетический анализ и позволяет выделять мутантов с утраченными функциями; у диплоидного организма такие мутации находились бы в рецессивном состоянии (как это имеет место у культивируемых клеток млекопитающих) и поэтому их было бы труднее выявлять и учитывать. У обоих видов дрожжей в контроле клеточного цикла важную роль играют питание и половой процесс; в связи с этим дрожжи послужат хорошим объектом для рассмотрения общего вопроса о том, как цикл деления регулируется факторами внеклеточной среды.
цикла в определенной его фазе [12, 13]
Чтобы идентифицировать гены, участвующие в контроле клеточного цикла, нужны соответствующие мутанты и способы получения от них потомства. Однако клетки с нарушенным механизмом клеточного цикла
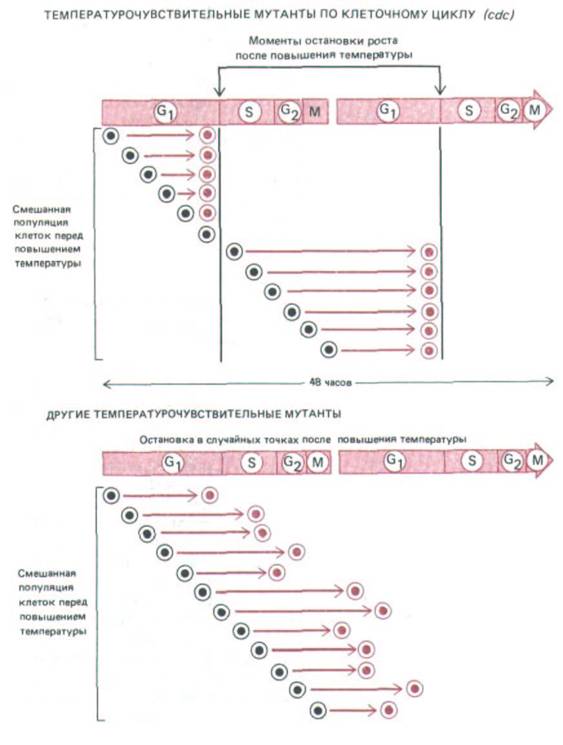
Рис. 13-18. Эти схемы показывают, как можно отличить термочувствительвого мутанта с измененным механизмом клеточного цикла (cdc) от других термочувствительных мутантов. При повышении температуры до рестриктивного уровня, когда продукт мутантного гена не может функционировать нормально, мутант будет продолжать свой клеточный цикл до тех пор, пока не дойдет до этапа, который он не в состоянии пройти (в данном случае это инициация фазы S). Поскольку, несмотря на блокаду цикла, клетка продолжает расти, мутанты cdc становятся ненормально большими (на схеме не показано). Между тем при других мутациях, вызывающих нарушение процессов, необходимых для роста на протяжении всего цикла (таких, как синтез АТР), клетка будет останавливаться в любой стадии цикла, как только она израсходует свои биохимические резервы.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
не способны размножаться. Выход из положения состоит в поиске условных мутантов, у которых дефект проявляется в фенотипе только при определенных условиях. Обычно ищут генный продукт, молекулярная структура которого слегка изменена так, что он утрачивает свою функцию в одном (рестриктивном) диапазоне температур, но сохраняет ее в другом (пермиссивном) диапазоне. Для таких термочувствительных мутаций низкие температуры обычно бывают пермиссивными, а высокие-рестриктивными. Таким образом, можно получить мутанта при низкой температуре, а затем, подняв ее, выключить измененный ген и исследовать мутантный фенотип.
Мутации, специфически влияющие на отдельные компоненты механизма клеточного цикла, нельзя обнаружить по одной лишь утрате способности мутантных клеток к делению, так как к этому будет приводить любой летальный дефект. Мутации цикла клеточного деления (cdc-
cell-division-cycle) более достоверно выявляются по тому, как они блокируют или нарушают специфическую фазу клеточного цикла при пермиссивной температуре (рис. 13-18). У почкующихся дрожжей наличие и размеры почки служат простым визуальным индикатором, показывающим, какой этап клеточного цикла блокирован у данного мутанта cdc; в случае делящихся дрожжей нужны более сложные подходы с использованием методов анализа клеточного цикла, о которых говорилось выше.
У каждого из двух упомянутых видов дрожжей было идентифицировано от 40 до 50 генов cdc. В ряде случаев биохимический анализ позволил точно определить функцию генного продукта. Например, некоторые мутанты cdc, у которых цикл блокирован в S-фазе, оказались дефектными по генам, кодирующим ДНК-лигазу или ферменты, необходимые для синтеза предшественников ДНК. Как будет описано ниже, общим подходом для характеристики всех белков, кодируемых генами cdc, может служить метод рекомбинантной ДНК. Однако некоторые важные моменты можно выяснить даже без этой информации.
|
|
Дата добавления: 2015-08-31; Просмотров: 960; Нарушение авторских прав?; Мы поможем в написании вашей работы!