
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Молекулы проколлагена типов I, II и III после их секреции расщепляются с образованием молекул
|
|
|
|
14-13
14.2.7. Секретируемые коллагены имеют на обоих концах неспиральные участки [14, 15]
Отдельные полипептидные цепи коллагена синтезируются на рибосомах, связанных с мембраной, и переходят в просвет эндоплазматического ретикулума в виде более длинных предшественников, называемых про- α -цепями. У этих предшественников имеется не только короткий «сигнальный пептид» на аминном конце, необходимый для того, чтобы «протащить» секретируемый белок через мембрану ретикулума (разд. 8.6.5), но и группы других дополнительных аминокислот, называемые пропептидами, на аминном и карбоксильном концах. В просвете эндоплазматического ретикулума остатки пролина и лизина гидроксилируются с образованием гидроксипролина и гидроксилизина соответственно.
Затем каждая про-а-цепь с помощью водородных связей объединяется с двумя другими в трехцепочечную спиральную молекулу, известную как проколлаген (рис. 14-34). Секретируемые формы фибриллярных коллагенов (но не коллаген типа IV) во внеклеточном пространстве преобразуются в молекулы коллагена путем отщепления пропептидов (см. ниже).
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
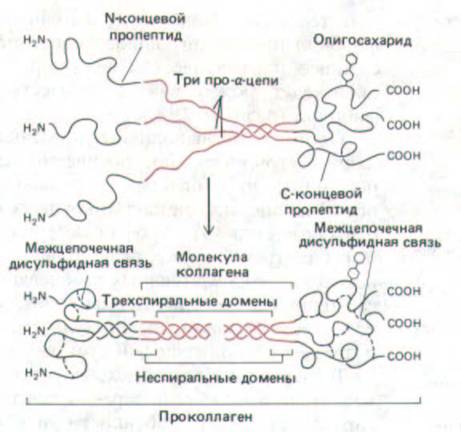
Рис. 14-34. В молекулах фибриллярного коллагена α-цепи вначале синтезируются в форме про-α-цепей, содержащих дополнительные пептиды на обоих концах (выделены черным цветом), которые позднее отщепляются. По-видимому, С-концевой пропептид способствует формированию тройной спирали при сборке молекулы проколлагена. Обратите внимание, что С-концевые пропептиды в молекуле проколлагена ковалентне соединены между собой дисульфидными связями и часто содержат олигосахаридную цепь. Аминоконцевые пропептиды образуют короткий трехцепочечный «миниколлагеновый» участок. Окончательная молекула коллагена содержит только часть молекулы проколлагена, выделенную красным цветом; остальные участки расщепляются.
|
|
|
В других белках остатки гидроксипролина и гидроксилизина {рис. 14-35) встречаются редко. Почему они присутствуют в коллагене?
Есть косвенные указания на то, что гидроксильные группы остатков гидроксипролина образуют водородные мостики между цепями, стабилизирующие трехцепочечную спираль. В частности, условия, препятствующие гидроксилированию пролина (например, недостаток аскорбиновой кислоты - витамина С), ингибируют формирование спирали проколлагена. В нормальных условиях коллагены непрерывно (хотя и медленно) расщепляются специфическими внеклеточными ферментами - коллагеназами. При цинге - заболевании, развивающемся у человека при нехватке витамина С в пище,-негидроксилированные про-α-цепи не способны образовать тройную спираль и тотчас же разрушаются; поэтому в результате постепенной потери существовавшего ранее нормального коллагена в матриксе кровеносные сосуды становятся чрезвычайно хрупкими, а зубы начинают шататься. Это означает, что распад и замещение коллагена происходят здесь относительно быстро. Однако во многих других тканях взрослого организма обновление коллагена (и других макромолекул внеклеточного матрикса) в норме происходит очень медленно; крайним примером может служить кость, где молекулы коллагена существуют около 10 лет до распада и замещения. Для сравнения отметим, что у большинства клеточных белков время полужизни измеряется часами или днями.
Гидроксилирование остатков лизина играет иную роль: оно необходимо для осуществления необычной разновидности гликозилирования (функция которого неизвестна) и имеет решающее значение для поперечной сшивки молекул коллагена при его организации во внеклеточном пространстве (разд. 14.2.9).
|
|
|
коллагена, которые объединяются в фибриллы [16]
После секреции пропептиды молекул проколлагена типов 1, II и III разрушаются специфическими ферментами уже вне клетки, и проколлаген превращается в коллаген (называемый также тропоколлагеном}. Образовавшиеся молекулы коллагена толщиной 1,5 нм объединяются во внеклеточном пространстве в значительно более крупные коллагеновые фибриллы (толщиной 10-300 нм). Фибриллы образуются частично за
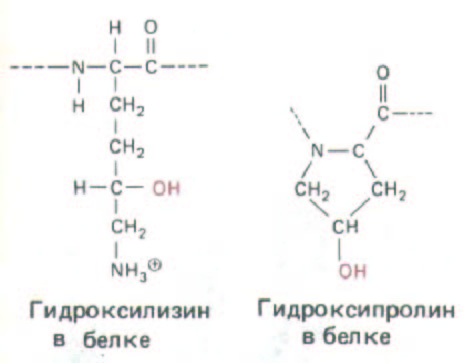
Рис. 14-35. Структура остатков гидроксипролина и гидроксилизина -двух измененных аминокислот, обычно содержащихся в коллагене.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
счет тенденции молекул коллагена к самосборке. Однако образование фибрилл происходит вблизи клеточной поверхности, часто в глубоких складках плазматической мембраны, и лежащий под нею кортикальный цитоскелет может влиять на место, скорость и ориентацию сборки фибрилл (разд. 14.2.18).
Пропептиды выполняют по меньшей мере две функции: 1) направляют внутри клетки построение трехцепочечных молекул коллагена; и 2) поскольку они отщепляются только после секреции, они препятствуют образованию внутри клетки крупных коллагеновых фибрилл, что имело бы для клетки катастрофические последствия. Однако столь же важно и избавиться от уже выполнивших свою задачу пропептидов. При некоторых наследственных заболеваниях, например при синдроме Элерса-Дэнлоса, этот процесс нарушен, а потому нарушено и образование коллагеновых фибрилл; в результате больные обладают хрупкой кожей и чрезмерно подвижными суставами.
В электронном микроскопе фиксированные и окрашенные фибриллы коллагена выглядят поперечно исчерченными с периодом 67 нм.
Такая картина отражает особенности упаковки отдельных молекул в фибриллу: как показано на рис. 14-36, они располагаются так, что соседние молекулы сдвинуты друг относительно друга почти на четверть своей длины (на 67 нм). Такое расположение, по-видимому, максимально повышает прочность агрегата на растяжение и создает исчерченность, видимую на негативно контрастированных фибриллах (рис. 14-37). Однако все еще не ясно, как при таких сдвигах молекулы упакованы в трехмерной цилиндрической фибрилле.
|
|
|
После того как коллагеновые фибриллы сформировались во внеклеточном пространстве, их прочность сильно возрастает благодаря созда-

Рис. 14-36. Схема ступенчатого расположения молекул коллагена (они изображены в виде стрелок) в коллагеновой фибрилле. Молекулы в соседних рядах сдвинуты друг относительно друга на 67 нм, а промежутки между молекулами в продольном ряду составляют 35 нм. При такой величине этого промежутка продольное расположение молекул повторяется через каждые пять рядов, так что, например, молекулы в рядах 1 и 6
лежат точно друг против друга.

Рис. 14-37. Эта схема объясняет, каким образом ступенчатое расположение молекул коллагена приводит к поперечной исчерченности фибриллы после негативного контрастирования. Поскольку контрастирующее вещество заполняет только промежутки между молекулами в каждом ряду, эти промежутки выглядят как темные полосы. Внизу - электронная микрофотография негативно контрастированной фибриллы (любезно предоставлена Robert Horne.)
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.

Рис. 14-38. Внутримолекулярные и межмолекулярные сшивки между модифицированными боковыми цепями лизина в коллагеновой фибрилле. Сшивки образуются в несколько этапов. Вначале некоторые остатки лизина и гидроксилизина дезаминируются внеклеточным ферментом лизилоксидазой, и здесь появляются альдегидные группы, обладающие высокой реакционной способностью. Затем эти группы самопроизвольно реагируют с образованием ковалентных связей друг с другом или с другими остатками лизина или гидроксилизина, так что в сшивке может участвовать более двух аминокислотных боковых цепей. Некоторые из образуемых связей относительно нестабильны и в конце концов модифицируются, превращаясь в разнообразные более стабильные сшивки. Обратите внимание, что большинство сшивок образуется между короткими неспиральными сегментами на обоих концах молекул коллагена (см. рис. 14-35).
|
|
|
нию ковалентных сшивок между остатками лизина внутри коллагеновых молекул и между ними (рис. 14-38). Ковалентные связи такого типа встречаются только в коллагене и эластине. Если блокировать их образование, содержащие коллаген ткани становятся хрупкими и такие структуры, как кожа, сухожилия и кровеносные сосуды, будут легко разрываться. Количество и тип сшивок изменяются от ткани к ткани. Например, в ахилловом сухожилии, для которого прочность на разрыв очень важна, такие сшивки в коллагене особенно многочисленны.
14.2.9. Организация коллагеновых фибрилл во внеклеточном матриксе приспособлена к потребностям ткани [17]
Коллагеновые фибриллы имеют разную толщину и по-разному организуются в различных тканях. Например, в коже млекопитающих они расположены наподобие прутьев в плетеных изделиях и поэтому сопротивляются нагрузкам по всем направлениям. В сухожилии они собраны в параллельные пучки, уложенные вдоль главной оси, а в зрелой костной ткани и роговице их расположение напоминает чередующиеся слои в фанере - фибриллы каждого слоя уложены параллельно друг другу почти под прямым углом к фибриллам соседних слоев. Так же организованы они и в коже головастика (рис. 14-39).
Сами клетки соединительной ткани определяют размер и расположение коллагеновых фибрилл. В клетках могут экспрессироваться один или несколько генов для разных типов молекул фибриллярного проколлагена (в том числе и минорные типы, не представленные в табл. 14-3), и клетки могут таким образом регулировать распределение молекул после их секреции. Контролируя порядок, в котором последовательно отщепляются пропептиды аминного и карбоксильного концов, секретируя наряду с коллагеном различные виды и количества неколлагеновых макромолекул матрикса и направляя формирование коллагеновых фибрилл в тесной взаимосвязи с плазматической мембраной, клетки могут определять геометрию и свойства фибрилл в своем ближайшем окружении. Наконец, образование большего или меньшего числа сшивок в коллагене зависит от требуемой прочности на растяжение. На рис. 14-40 схематически представлены этапы синтеза фибриллярного коллагена и сборки структур высшего порядка.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 1078; Нарушение авторских прав?; Мы поможем в написании вашей работы!