
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вещества, изменяющие структуру и физико-химические свойства пищевых продуктов 2 страница
 |
Из-за наличия в пектиновых молекулах диссоциирующих свободных карбоксильных групп их водные растворы имеют кислую реакцию (для 2,5%-го раствора пектина рН около 3).
Образование гелевой структуры в растворах пектинов происходит в результате взаимодействия пектиновых молекул между собой и зависит от особенностей строения молекулы — молекулярной массы, степени этерификации, характера распределения карбоксильных групп. Кроме этого, на процесс гелеобразования оказывают влияние температура, рН среды и содержание дегидратирующих веществ.
Формирование пространственной структуры геля может происходить двумя путями: а) за счет изменения сил электростатического отталкивания пектиновых молекул в присутствии дегидратирующих веществ
(сахарозы) в кислой среде (сахарно-кислотное гелеобразование); б) с участием ионов поливалентных металлов.
Тип ассоциации пектиновых молекул определяется степенью этерификации. Высокоэтерифицированные пектины образуют гели в присутствии кислоты (рН 3,1—3,5) при содержании сухих веществ (сахарозы) не менее 65%, низкоэтерифицированные — как по первому типу, так и в присутствии ионов поливалентных металлов, например, кальция, независимо от содержания сахарозы, в широком диапазоне рН (от 2,5 до 6,5). Пектины высокой степени этерификации образуют высокоэластичные гели, которые имеют тенденцию возвращаться в исходное состояние после изменения формы при механическом сдвиге.
Пектины низкой степени этерификации, в зависимости от концентрации ионов кальция, могут давать различные по консистенции гели — от высоковязких (не восстанавливающих исходную форму после деформирования) до высокоэластичных.
|
|
|
Комплексообразующая способность (образование циклических комплексов поливалентных металлов) различных пектинов зависит от содержания свободных карбоксильных групп, то есть степени этерификации пектиновых молекул, и не зависит от их молекулярной массы.
Способность пектиновых молекул связывать поливалентные катионы увеличивается при снижении степени их этерификации и повышении степени диссоциации свободных карбоксильных групп (т.е. при повышении рН среды), а по отношению к различным металлам изменяется в ряду [Paskins-Hurlburt A.J. et al.,1977]:
Mg < Mn < Сr < Hg < Fe < Ni < Со < Сu < Zn < Sr < Cd < Ва < Pb.
Молекулы высокоэтерифицированных пектинов могут образовывать пектин—протеиновые комплексы. При рН 4,0—4,2 они вступают во взаимодействие с молекулами казеина молока, что приводит к изменению общего заряда белковых молекул и обеспечивает их физическую стабильность в кислой среде.
Кроме того, пектины, как растворимые пищевые волокна, являются физиологически ценными пищевыми добавками (функциональными ингредиентами), присутствие которых в пищевых продуктах традиционного рациона способствует улучшению состояния здоровья человека. Специфическое физиологическое воздействие растворимых пищевых волокон связано с их способностью снижать уровень холестерина в крови, нормализовать деятельность желудочно-кишечного тракта, связывать и выводить из организма некоторые токсины и тяжелые металлы. Рекомендуемое суточное потребление пектиновых веществ в рационе здорового человека составляет 5—6 г.
Галактоманнаны: камедь рожкового дерева, гуаровая камедь
Галактоманнаны представляют собой гетерогликаны, содержащиеся в семенах стручковых растений и выполняющие функцию предотвращения обезвоживания семян. Коммерческие препараты растительных га-лактоманнанов получили название камеди. Наиболее распространенными в качестве пищевых добавок в этой группе являются Галактоманнаны семян двух видов растений — гуара (Cyamopsis tetragonolobus), произрастающего в Индии и Пакистане, и рожкового дерева (Ceratonia siligua), произрастающего на побережье Средиземного моря.
|
|
|
Эти камеди (Е410 и Е412) имеют сходное химическое строение и представляют собой нейтральные полисахариды, состоящие из (3-(1,4) гликозидно связанных остатков маннозы, к которым (1,6)-связями через равные интервалы присоединены боковые цепи, состоящие из единичных остатков a-D-галактозы. У камеди гуара, получившей название гуаран, остаток галактозы присоединен к каждому второму остатку маннозы, а у камеди из бобов рожкового дерева — к каждому четвертому (рис. 9.5). Причем галактопиранозные структурные единицы распределены вдоль полимерной цепи маннана не равномерно, а блочно, что особенно характерно для галактоманнанов рожкового дерева. Таким образом, полимерная цепь галактоманнанов имеет нерегулярную структуру с чередующимися линейными и разветвленными зонами. От характера распределения этих зон, а также от соотношения галактозы и маннозы зависят основные свойства галактоманнанов.
Технология получения коммерческих препаратов галактоманнанов основана на водной экстракции полисахаридов из измельченного растительного сырья с последующим отделением и очисткой экстракта, обработкой его спиртом для выделения целевого продукта, который затем отфильтровывают, высушивают и измельчают.
Растворимость галактоманнанов в воде зависит от особенностей их строения. Галактоманнаны с высокой степенью замещения первичных гидроксильных групп в остатках D-маннозы (гуаран) полностью растворяются в холодной воде, а Галактоманнаны с ограниченной степенью замещения (камедь рожкового дерева) — только в горячей. Однако в обоих случаях процесс растворения является продолжительным и ускоряется за счет интенсивного перемешивания или нагревания, при котором температура не должна превышать 80°С из-за потенциально возможной термической деструкции полимерных молекул.
Вязкость растворов галактоманнанов зависит от их концентрации. При низких концентрациях (до 0,5%) она имеет линейную зависимость, которая при дальнейшем повышении дозировок переходит в экспоненциальную.
|
|
|
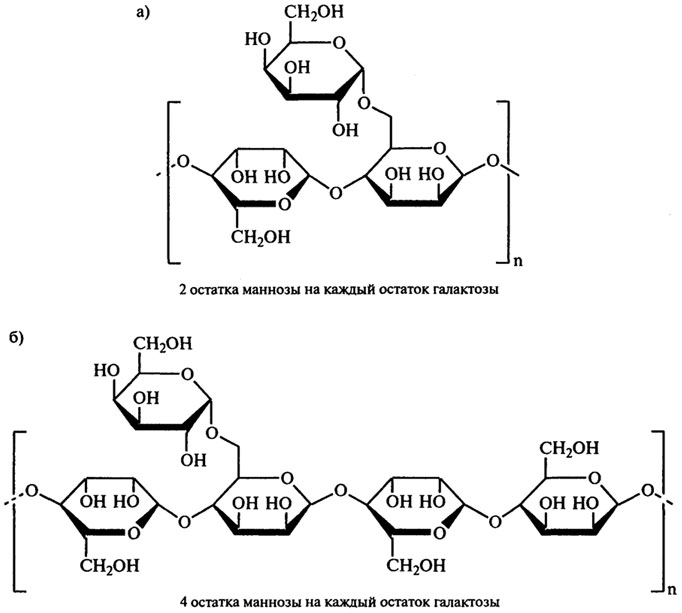
Рис. 9.5. Фрагмент молекулы галактоманнанов:
а) камедь гуара; б) камедь рожкового дерева
Полисахариды морских растений
Коммерческие препараты этой подгруппы пищевых добавок объединяют полисахариды, выделяемые из красных и бурых морских водорослей. В пищевой промышленности широко используются альгинаты, каррагинаны и агароиды.
Альгиновая кислота ( Е400) и ее соли (Е401—Е405) относятся к полисахаридам бурых морских водорослей родов Laminaria и Macrocystis (от лат. alga — водоросль), которые построены из остатков β-D-маннуроно-вой и β-L-гулуроновой кислот, находящихся в пиранозной форме и связанных в линейные цепи (1,4)-гликозидными связями. Фрагменты молекул этих кислот в наиболее энергетически выгодной конформации (конформации кресла 4С1 и 1С4) представлены на рис. 9.6.

Рис. 9.6. Структурные фрагменты альгинатов
Распределение остатков мономеров этих кислот вдоль полимерной цепи носит блочный характер и образует три типа блоков:
— гомополимерные блоки из монотонных последовательностей остатков (β-D-маннуроновой кислоты (М-блоки);
— гомополимерные блоки из монотонных последовательностей остатков α-L-гулуроновой кислоты (Г-блоки);
— гетерополимерные блоки с регулярным чередованием остатков обеих кислот (М-Г-блоки).
Такое строение полимерных молекул приводит к образованию зон кристалличности в Г-блоках, аморфных участков (зон гибкости) в М-блоках и участков с промежуточной жесткостью в гетерополимерных М-Г-блоках. Соотношение полимеров и характер их распределения в молекулах альгинатов меняются в широких пределах в зависимости от сырьевого источника. Степень полимеризации молекул составляет обычно 100— 300, что соответствует молекулярной массе от 200 тыс до 600 тыс.
Технологический процесс получения альгинатов основан на щелочной экстракции разбавленными растворами соды или щелочей в виде хорошо растворимых натриевых или калиевых солей. При подкислении экстракта из раствора выделяют собственно альгиновые кислоты, которые в связи с их ограниченной стабильностью, как правило, переводят в различные солевые формы. Статус пищевых добавок, наряду с аль-гиновой кислотой, имеют 5 альгинатов (см. табл. 9.9).
|
|
|
Растворимость этих добавок в воде зависит от природы катиона в мономерных остатках, формирующих молекулы рассматриваемых гетерогликанов. Свободные альгиновые кислоты плохо растворимы в холодной воде, но набухают в ней, связывая 200—300-кратное количество воды, однако растворимы в горячей воде и в растворах щелочей, образуя при подкислении гели. Натриевые и калиевые соли альгиновых кислот легко растворимы в воде с образованием высоковязких растворов. Соли с двухвалентными катионами образуют гели или нерастворимые альгинаты.
Таблица 9.9. Пищевые альгинаты
| Код | Название | Природа катиона в мономерном остатке |
| Е400 | Альгиновая кислота | Н |
| Е401 | Альганат натрия | Na |
| Е402 | Альгинат калия | К |
| Е403 | Альгинат аммония | МН4 |
| Е404 | Альгинат кальция | Са1/2 |
| Е405 | Пропиленгликольальгинат (ПГА) | 
|
Вязкость растворов альгинатов связана с длиной полимерной молекулы альгината, в связи с чем коммерческие препараты имеют, как правило, определенную молекулярную массу. В этом случае вязкость растворов изменяется пропорционально концентрации добавки. При низких концентрациях повышение вязкости может быть достигнуто путем введения небольшого количества ионов кальция, которые, связывая молекулы, приводят фактически к повышению молекулярной массы и, как следствие, к повышению вязкости. Превышение дозировки ионов кальция может привести к гелеобразованию.
Образование гелевой структуры в растворах альгинатов происходит с участием ионов бивалентного кальция путем взаимодействия их молекул между собой в зонах кристалличности. В связи с этим гелеобразующая способность и прочность гелей непосредственно связаны с количеством и длиной зон кристалличности.
Агар (агар-агар) Е406 — смесь полисахаридов агарозы и агаропектина. Основная фракция агарозы — линейный полисахарид, построенный из чередующихся остатков p-D-галактопиранозы и 3,6-ангидро-α-β-галактопиранозы, связанных попеременно |3-(1,4)- и а-(1,3)-связями. Агаропектин — смесь полисахаридов сложного строения, содержащая глюкуроновую кислоту и эфирносвязанную серную кислоту.
Агар-агар получают из красных морских водорослей (Gracilaria, Gelidium, Ahnfeltia), произрастающих в Белом море, Тихом и Атлантическом океанах. В зависимости от вида водорослей состав выделенных полисахаридов может

изменяться. Агар незначительно растворяется в холодной воде, но набухает в ней. В горячей воде он образует коллоидный раствор, который при охлаждении дает хороший прочный гель, обладающий стекловидным изломом. У агара этот процесс осуществляется за счет образования двойных спиралей и их ассоциации независимо от содержания катионов, сахара или кислоты. Гелеобразующая способность агара в 10 раз выше, чем у желатина. При нагревании в присутствии кислоты способность к гелеобразованию снижается. Гели стабильны при рН более 4,5 и термообратимы.
Каррагинаны (Е407) объединяют семейство полисахаридов (известное также под названием ирландский мох), содержащихся, наряду с агаром, в красных морских водорослях Chondrus Crispis, Eucheuma Species, Gigartina Species и др. По химической природе каррагинаны близки к агароидам и представляют собой неразветвленные сульфатированные гете-рогликаны, молекулы которых построены из остатков производных D-галактопиранозы со строгим чередованием α-(1,3)- и β-(1,4)-связей между ними, т. е. из повторяющихся дисахаридных звеньев, включающих остатки β-D-галактопиранозы и 3,6-ангидро-α-В-галактопиранозы. В зависимости от особенностей строения дисахаридных повторяющихся звеньев различают три основных типа каррагинанов, для обозначения которых используют буквы греческого алфавита:

В κ- и ι-каррагинанах левые галактозные остатки дисахаридных повторяющихся звеньев содержат сульфатированные гидроксильные группы при четвертом атоме углерода, а правый галактозный остаток находится в 3,6-ангидроформе и имеет сульфатированный гидроксил при втором атоме углерода в ι-каррагинане и несульфатированный — в κ-типе.
Сульфатные группы в молекулах коммерческих каррагинанов могут быть замещены на ионы натрия, калия или аммония. Коммерческие препараты обычно содержат сопутствующий полисахарид — фурцеллеран.
Принципиальным для условий формирования гелевых структур является конформационное состояние моносахаридных остатков. В повторяющихся дисахаридных звеньях, формирующих макромолекулы каррагинанов, оба галактопиранозных остатка находятся в конформации "кресла", причем, в κ- и ι-каррагинанах правый остаток имеет конформацию 4С1, а левый — конформацию 1С4.
В λ-каррагинане оба галактозных фрагмента находятся в конформации 4С1. Именно наличие двух типов конформации в дисахаридном звене обусловливает способность каррагинановых молекул к образованию двойных спиралей, ассоциация которых приводит к гелеобразованию.
Технологический процесс получения каррагинанов основан на их экстракции горячей водой с последующим выделением из раствора. В промышленности используют два способа выделения:
а) через гелеобразование в среде с хлоридом калия — для выделения гелеобразующих каррагинанов;
б) осаждением из спирта — при выделении смеси всех трех типов.
Основные свойства каррагинанов представлены в табл. 9.10, из которой видно, что все три вида каррагинанов растворимы в горячей воде, а в виде натриевых солей они растворимы и в холодной воде с образованием вязких растворов, κ- и ι-каррагинаны являются гелеобразователями, а λ-тип — загустителем. Растворы гелеобразующих каррагинанов становятся твердыми и образуют гели при температуре ниже 49—55°С. Эти гели устойчивы при комнатной температуре, но могут быть вновь расплавлены при нагревании до температуры, превышающей температуру гелеобразования на 5—10°С. При охлаждении такого расплава вновь образуется гель.
Механизмы загущения и гелеобразования у различных типов каррагинанов неодинаковы. κ-Каррагинан связывает воду и образует прочный гель в присутствии ионов калия, a ι- и λ-каррагинаны в этих условиях проявляют лишь незначительную реакцию. Для образования геля ι-кар-рагинаном необходимо присутствие ионов кальция, которые образуют связи между отдельными молекулами биополимера с формированием спирали. Отрицательные заряды, связанные с наличием двух сульфатных групп в дисахаридных блоках ι-каррагинанов, не позволяют спиралям этих каррагинанов агрегатировать с той же степенью, что и в κ-каррагинанах. По этой причине ι-каррагинаны образуют обычно эластичные прозрачные гели, не склонные к синерезису и устойчивые в условиях замораживания и оттаивания.
Таблица 9.10. Свойства каррагинанов
| Среда | Тип каррагинана | ||
| каппа | йота | лямбда | |
| Растворимость | |||
| Вода, 80°С | Да | Да | Да |
| Вода, 20°С | Na-соль | Na-соль | Да |
| К-, Са- и NН4-соли набухают | Са — соль набухает с образованием тиксотропной дисперсии | Да | |
| Молоко, 80°С | Да | Да | Да |
| Молоко, 20°С | Нет | Нет | Загущает |
| 50%-й раствор сахара | При нагревании | Нет | Да |
| 5%-й раствор соли | |||
| горячий | Набухает | Набухает | Да |
| холодный | Нет | Нет | Да |
| Гелеобразование | |||
| Прочные гели | C ионами К | С ионами Са | Нет |
| Текстура геля | Хрупкий | Эластичный | — |
| Синерезис | Да | Нет | Нет |
| Стабильность при замораживании/оттаивании | Нет | Да | Да |
| Взаимодействие с белками молока | Хрупкий гель | Эластичный гель | Слабый гель |
| Стабильность гелей в кислой среде | Устойчив выше рН 3,8 | Устойчив выше рН 3,8 | Не применяется |
Молекулы λ-каррагинанов являются более высокосульфатированны-ми, что делает образование гелевой структуры менее вероятным, поскольку сульфатные эфиры не соединяются с ионами калия с образованием спиралей из-за ионизации сульфатных групп даже в кислой среде. В этих условиях полимерные молекулы сохраняют произвольное распределение и образуют вязкие растворы при охлаждении.
Наличие отрицательно заряженных сульфатных групп в молекулах каррагинанов обусловливает их способность к комплексообразованию с казеиновыми мицеллами молока, имеющими в периферийных (внешних) зонах высокую концентрацию положительных зарядов. Это взаимодействие в комбинации с водопоглотительной способностью
синергетически увеличивает прочность геля приблизительно в 10 раз, то есть одна и та же прочность геля достигается в молочной системе при концентрации каррагинана в 10 раз меньшей, чем в водной среде, κ- и ι-Каррагинаны образуют гели с молоком при концентрациях 0,02—0,2%.
Ксантановая камедь или камедь кукурузного сахара (Е415) представляет собой смесь полисахаридов, образующихся как вторичные метаболиты при аэробной ферментации Сахаров (например, кукурузного сиропа) бактериями Xanthomonas campestris. По химической природе это гетерополисахарид с молекулярной массой от одного до нескольких миллионов, молекулы которого формируются из трех типов моносахаридов: β-D-глюкозы, α-D-маннозы и α-D-глюкуроновой кислоты при их соотношении 2:2:1. Структурной единицей молекулы ксантана является повторяющийся пентасахаридный фрагмент, имеющий строение:

Молекулы β-D-глюкозы, соединяясь 1,4-гликозидной связью, образуют основную цепь, где каждый второй глюкозный остаток содержит короткое боковое звено из трех моносахаридных единиц, в котором остаток глюкуроновой кислоты располагается между двумя остатками α-D-маннозы. Конечный остаток маннозы может содержать пируватную группу, а манноза, примыкающая к основной цепи, — ацетатную группу при шестом углеродном атоме. Как правило, каждое второе боковое ответвление содержит пируватную группу, однако соотношение пируватных и ацетатных групп зависит от вида микроорганизма и условий получения.
Растворимость ксантанов в воде определяется наличием регулярных боковых звеньев с кислотными группировками, вызывающих взаимное отталкивание отдельных молекул, что приводит к повышению их гидратации. В связи с этим ксантаны растворяются в воде уже при комнатной температуре, кроме того, хорошо растворимы в горячем и холодном молоке, в растворах соли и сахара.
Обычно молекулы ксантанов представляют собой единичные или двойные спирали, подобные жестким стержням, не проявляющим
тенденции к ассоциации, что объясняет их поведение в растворах. Ксантаны являются загустителями и при температурах до 100°С образуют растворы высокой вязкости, которая мало зависит от температуры и стабильна в диапазоне рН от 1 до 13.
Желатин
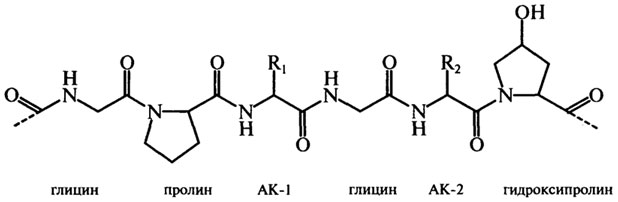
Желатин является практически единственным гелеобразователем белковой природы, который широко используется в пищевой промышленности. Желатин — белковый продукт, представляющий смесь линейных полипептидов с различной молекулярной массой (50 000—70 000) и их агрегатов с молекулярной массой до 300 000, не имеет вкуса и запаха. Аминокислотный состав желатина включает до 18 аминокислот, в том числе глицин (26—31 %), пролин (15—18%), гидроксипролин (13—15%), глутаминовую кислоту (11— 12%), аспарагиновую кислоту (6—7%), аланин (8—11%) и аргинин (8—9%).
Фрагмент молекулы желатина имеет следующий вид (АК — аминокислота):
Электрокинетические свойства желатина в растворе, в том числе изоэлектрическая точка, определяются пятью электроактивными аминокислотами. В молекулах желатина основными функциональными группами, несущими заряд, являются:
— СООН-группы аспарагиновой и глутаминовой кислот;
— NН2-группы лизина и гидроксилизина;
— 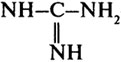 -группы аргинина.
-группы аргинина.
На их долю приходится более 95% всех ионизированных групп желатина.
Желатин получают из коллагена, содержащегося в костях, хрящах и сухожилиях животных. Технологический процесс основан на кислотной или щелочной экстракции, в процессе которой нерастворимый коллаген превращается в растворимый желатин, с последующим выделением продукта известными технологическими приемами,
предусматривающими его очистку, высушивание и стандартизацию. В коллагене 35% кислотных групп находится в амидированной форме, которая преобразуется в кислотную в процессе щелочной обработки. Поэтому изоэлектри-ческая точка желатина варьирует между 9,4 (для амидированной формы) и 4,8 (для карбоксильной формы).
Желатин растворяется в воде, молоке, растворах солей и сахара при температуре выше 40°С. Растворы желатина имеют низкую вязкость, которая зависит от рН и минимальна в изоэлектрической точке. При охлаждении водного раствора желатина происходит повышение вязкости с переходом в состояние геля. Это так называемый золь-гель-переход. Условиями образования геля являются достаточно высокая концентрация желатина и соответствующая температура, которая должна быть ниже точки затвердевания (примерно 30°С).
При охлаждении сегменты, богатые аминокислотами различных полипептидных цепей, принимают спиральную конфигурацию. Водородные связи с участием или без участия молекул воды стабилизируют образовавшуюся структуру. Эти связи распределены по всей длине цепи, что объясняет уникальные свойства желатиновых гелей.
Наиболее интересным свойством желатина является образование термически обратимых гелей. В противоположность полисахаридам, гелеобразование желатина не зависит от рН и не требует присутствия других реагентов, как например, Сахаров, солей или двухвалентных катионов.
374:: 375:: 376:: 377:: 378:: 379:: 380:: 381:: 382:: 383:: 384:: 385:: 386:: 387:: 388:: 389:: 390:: 391:: 392:: 393:: 394:: 395:: 396:: 397:: 398:: 399:: Содержание
399:: 400:: 401:: 402:: 403:: 404:: 405:: 406:: 407:: 408:: 409:: 410:: 411:: Содержание
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 1165; Нарушение авторских прав?; Мы поможем в написании вашей работы!