
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
От температуры. Уравнение Кирхгофа
|
|
|
|
Зависимость теплового эффекта химической реакции
Согласно следствиям из закона Гесса, можно вычислить тепловой эффект реакции при той температуре (обычно 298,15 К), при которой известны теплоты образования или теплоты сгорания всех реагентов. На практике почти всегда необходимо знать тепловые эффекты реакции при различных температурах.
Запишем уравнение химической реакции в общем виде
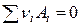 или
или 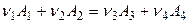 , (2.61)
, (2.61)
где символы Аi обозначают вещества в любом агрегатном состоянии,
νi – стехиометрические коэффициенты.
Каждый из участников этой реакции имеет определенную молярную энтальпию Нi. Если реакция совершила один пробег, т.е. вступило в реакцию число молей каждого вещества, равное стехиометрическому коэффициенту, то изменение энтальпии (энтальпия реакции) будет равно алгебраической сумме энтальпий компонентов (стехиометрические коэффициенты продуктов реакции берутся со знаком плюс, а исходных веществ – со знаком минус):
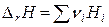 или
или 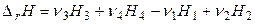 . (2.62)
. (2.62)
Продифференцируем уравнение (2.62) по температуре при постоянном давлении:
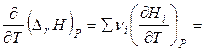
 . (2.63)
. (2.63)
Но производная

есть изобарная теплоемкость i -го компонента, поэтому
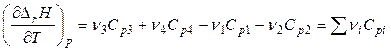 . (2.64)
. (2.64)
Алгебраическую сумму теплоемкостей 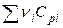 обозначают
обозначают 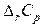 , тогда
, тогда
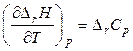 . (2.65)
. (2.65)
Температурный коэффициент энтальпии реакции равен разности сумм теплоемкостей продуктов реакции и сумм теплоемкостей исходных веществ с учетом стехиометрических коэффициентов.
Как для идеальных, так и для реальных систем при невысоких давлениях частную производную можно заменить полной, поэтому при стандартном давлении получаем:
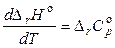 . (2.66)
. (2.66)
Аналогичным образом для процессов, протекающих при постоянном объеме, можно получить соотношение
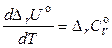 . (2.67)
. (2.67)
Уравнения (2.66) и (2.67) были получены Кирхгофом в 1858 году и называются уравнениями Кирхгофа.
|
|
|
Итак, влияние температуры на тепловой эффект реакции определяется знаком величины изменения теплоемкости в ходе реакции:
1) если 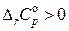 , то
, то 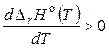 и с увеличением температуры тепловой эффект реакции будет возрастать;
и с увеличением температуры тепловой эффект реакции будет возрастать;
2) если 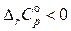 , то
, то 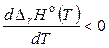 и с увеличением температуры тепловой эффект реакции будет уменьшаться;
и с увеличением температуры тепловой эффект реакции будет уменьшаться;
3) если 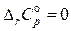 , то
, то 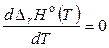 и тепловой эффект реакции не зависит от температуры.
и тепловой эффект реакции не зависит от температуры.
Необходимо отметить, что для некоторых реакций с изменением температуры 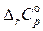 может изменять не только свою величину, но и знак.
может изменять не только свою величину, но и знак.
Разделив переменные в уравнении (2.66) и проинтегрировав в пределах от Т 1 до Т 2, получим уравнение Кирхгоффа в интегральной форме:
 , (2.68)
, (2.68)
где 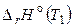 – энтальпия реакции при температуре Т 1, при этом обычно
– энтальпия реакции при температуре Т 1, при этом обычно
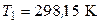 .
.
Аналогично можно получить уравнение, справедливое для химических реакций, протекающих при постоянном объеме:
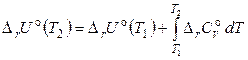 , (2.69)
, (2.69)
Для вычисления интеграла необходимо знать зависимость теплоемкости от температуры для всех участников реакции, что не всегда возможно. При отсутствии сведений или ограниченности данных по теплоемкостям некоторых участников реакции в расчетах по уравнению Кирхгофа используют следующие два приближения:
1). В самом грубом приближении полагают, что суммарные теплоемкости продуктов реакции и исходных веществ равны:
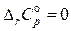
и пренебрегают температурной зависимостью теплового эффекта:
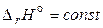 .
.
2). Во втором приближении принимают, что
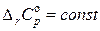 .
.
Тогда при интегрировании уравнения (2.68) величину изменения теплоемкости можно вынести за знак интеграла:
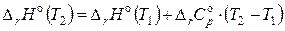 . (2.70)
. (2.70)
Последнее уравнение применяют только для небольших интервалов температур, в котором известны величины теплоемкостей реагентов.
В точных расчетах по уравнению Кирхгофа необходимо использовать температурные зависимости теплоемкостей участников реакции в виде степенных рядов. Последние справедливы в определенном интервале температур; нижним пределом этого интервала обычно выбирается 298,15 К.
|
|
|
Теплоемкость твердых, жидких и газообразных веществ повышается с ростом температуры (за исключением идеальных газов). Зависимость теплоемкости от температуры выражают в виде многочлена – температурного ряда:
для простых и неорганических веществ, как правило в виде
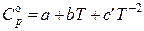 ,
,
для органических веществ, как правило, в виде
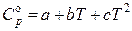 .
.
Коэффициенты в приведенных выражениях (справочник: табл. 44, стр. 72-91) вычисляются на основе экспериментальных данных по теплоемкости. Для газообразных веществ они могут быть определены также на основании значений теплоемкости, рассчитанных методами статистической термодинамики.
Таким образом, в общем виде зависимость теплоемкости i -го участника реакции от температуры выражается следующим полиномом:
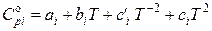 ,
,
где некоторые коэффициенты (в зависимости от природы вещества) могут быть равны нулю. Тогда
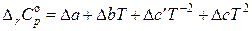 ,
,
где 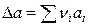 ,
, 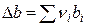 ,
, 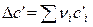 ,
, 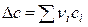 .
.
Следовательно, если принять Т 1 = 298,15 К, то уравнение (2.68) принимает следующий вид:

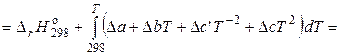
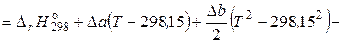
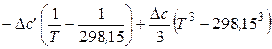 . (2.71)
. (2.71)
Уравнение (2.71) можно использовать только в том интервале температур, для которого определены коэффициенты температурной зависимости теплоемкости реагентов. Если реагент в данном температурном интервале испытывает фазовое превращение, то необходимо учесть изменение энтальпии в этом превращении.
Вычисление теплового эффекта реакции по уравнению Кирхгофа упрощается, если воспользоваться вместо температурных рядов средними теплоемкостями для реагентов (справочник: таблица 40, стр. 56-62). Средней теплоемкостью вещества в интервале (298,15 – Т) называется величина, вычисляемая по формуле
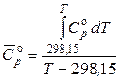 .
.
При использовании средних теплоемкостей веществ уравнение Кирхгофа преобразуется в следующее выражение:
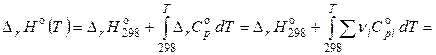
 ,
,
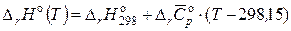 , (2.72)
, (2.72)
где 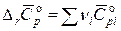 – разность средних теплоемкостей участников реакции в температурном интервале от 298,15 К до Т (с учетом стехиометрических коэффициентов).
– разность средних теплоемкостей участников реакции в температурном интервале от 298,15 К до Т (с учетом стехиометрических коэффициентов).
Так, например, для реакции
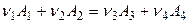
эта разность равна
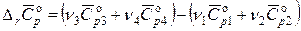 .
.
И, наконец, тепловой эффект реакции при T > 298,15 К можно вычислить на основе справочных данных по приращениям энтальпии реагентов (справочник: табл. 50, стр. 102-107):
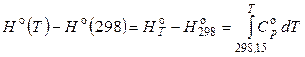
или
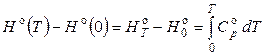 .
.
В этом случае уравнение Кирхгофа запишется следующим образом:
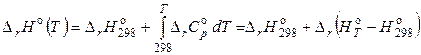 , (2.73)
, (2.73)
или
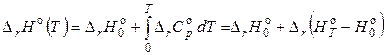 , (2.74)
, (2.74)
где 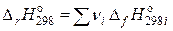 – энтальпия реакции при 298,15 К;
– энтальпия реакции при 298,15 К;
|
|
|
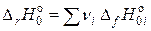 – энтальпия реакции при 0 К;
– энтальпия реакции при 0 К;
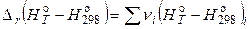 и
и 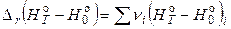 – разности приращений энтальпий веществ, участвующих в реакции (с учетом стехиометрических коэффициентов).
– разности приращений энтальпий веществ, участвующих в реакции (с учетом стехиометрических коэффициентов).
Например, энтальпия реакция при абсолютном нуле может быть получена из выражения:
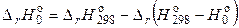 .
.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 2854; Нарушение авторских прав?; Мы поможем в написании вашей работы!