
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ожоговый шок
|
|
|
|
В лечении ожогового шока инфузионная терапия занимает ведущее место. Тяжелая термическая травма сопровождается, как известно, серьезными нарушениями внутренней среды организма. Своевременно и грамотно проводимая внутривенная терапия в состоянии воздействовать на эти изменения и восстановить нарушенный гомеостаз. Однако для этого необходимо знание патогенеза и защитных реакций организма, без чего невозможны правильный выбор инфузионных средств, расчет их дозировки и последовательность введения.
Патогенез. Ожоговый шок возникает вследствие сверхсильного патологического воздействия на ЦНС и глубокого нарушения механизмов саморегуляции основных систем гомеостаз а.
В первую очередь страдает регуляция системы гемодина-мики. Основным патогенетическим механизмом развития шока является гиповолемия, которая зависит в основном от двух причин. Во-первых, в связи с острой дилатацией сосудов возникает относительная гиповолемия. Сверхсильные патологические импульсы, поступающие в ЦНС, вызывают в ней перевозбуждение, а затем срыв — торможение. Во-вторых, на почве острой интенсивной плазмореи ожоговой поверхности, способной в течение 2—4 ч снизить ОЦК на 20—40%, развивается абсолютная гиповолемия, усугубляемая массивным внутрисосу диеты м гемолизом и патологическим депонированием крови, возникающим, как правило, при нарушении центрального и периферического кровообращения. Наконец, дефицит ОЦК может увеличить кровопотеря с раневой поверхности. Вслед за развитием гиповолемии ухудшается и центральная гемодинамика — снижаются УОС и МОК.
При недостаточности механизмов саморегуляции значительно нарушается кровообращение в органах и тканях, в связи с чем нарастают изменения в биохимическом составе крови. На фоне циркуляторной гипоксии и метаболического ацидоза в ней обнаруживаются недоокисленные продукты обмена, в частности молочная и пировиноградная кислоты, мочевина, фосфорные и другие соединения. Уменьшение объемного кровотока в печени ухудшает ее дезинтоксикаци-онную функцию. При глубоком нарушении гемодинамики в органе появляются некротические изменения в структуре долек, исчезают запасы гликогена и энергетических фосфорных соединений.
В это же время страдает и функция почек. При артериальном давлении ниже 8 кПа (60 мм рт. ст.) резко снижается клубочковая фильтрация мочи, прекращается ее секреция, наступает олигурия. Этому может способствовать вазоконстрикция почечных сосудов на почве поступления в кровоток избыточного количества катехоламинов.
Нарушения микроциркуляции. Значительная гемоконцентрация, возникающая на почве острой ожоговой плазмореи, является ведущим фактором в развитии глубоких нарушений реологических свойств крови, а следовательно, и микроциркуляции.
Сгущение крови и агрегация в капиллярном русле эритроцитов, а в ряде случаев и тромбоцитов, приводят к замедлению скорости капиллярного кровообращения вплоть до полной его остановки и выключению из циркуляции значительных количеств крови (депонирование). В периферическом кровотоке обнаруживаются микросгустки, включаются механизмы шунтирования крови через прекапилля-ры. На почве снижения содержания в крови тромбоцитов и фибриногена отмечается повышенная кровоточивость. В результате застоя в капиллярном кровообращении стенки сосудов (особенно венул) расширяются, что повышает их проницаемость для низкодисперсных белков. В конечном счете нарушается транскапиллярный обмен, главным образом белковый, водно-солевой и кислородный.
Нарушения белкового обмена. Обильная плазморея на большой ожоговой поверхности, как правило, сопровождается значительной потерей белков. При этом снижается коллоидно-осмотическое давление плазмы, что играет немаловажную роль в развитии гиповолемии и гипотонии. Кроме того, на почве повышенной проницаемости сосудов и изменения внутрисосудистого давления в связи с застоем крови плазменная ее часть, включая низкодисперсные белки, пропотевает в интерстициальные пространства. Происходит интенсивная плазморея на уровне капилляров, что приводит к отеку тканей. Величина этой плазмореи может достигать б—8 л. Такие нарушения транскапиллярного белкового обмена в системе микроциркуляции могут носить общий характер независимо от места термического поражения.
Нарушения води о-с олевого обмена при термических поражениях могут быть связаны с потерями внеклеточной жидкости. В результате проникновения ионов натрия в клетки пораженной ткани в обмен на содержащиеся в них ионы калия (по принципу калиевого насоса) осмотическое давление во внеклеточной жидкости заметно снижается, что в конечном итоге приводит в гидратации тканей. Она может быть особенно выражена в тех тканях, которые содержат большое количество калия и способны обменивать его на натрий (например, мышечная ткань). Кроме того, потери внеклеточной жидкости могут происходить непосредственно через открытую ожоговую поверхность.
Активность передней доли гипофиза и повышение содержания в крови АКТГ приводят к увеличению экскреции 17-ОКС. Гиперсекреция антидиуретического гормона вызывает реабсорбцию солей в почках и увеличение осмотического давления плазмы крови. В то же время повышение активности минералокортикоидов, выделяемых корой надпочечников, обусловливает задержку жидкости во внеклеточном секторе, еще более увеличивая гидратацию тканей.
В течение всего периода ожогового шока может наблюдаться гиперкалиемия.
Нарушения кислородного обмена. Ге-моконцентрация, развивающаяся в самом начале ожогового шока, нарушает кислородно-транспортную функцию крови. Это происходит по двум причинам. Во-первых, сгущение крови препятствует капиллярному кровообращению, а следовательно, и транскапиллярному обмену кислорода между кровью и тканями организма. Во-вторых, сгущение крови является результатом потери большого объема плазмы, но при этом имеет место и значительная потеря эритроцитов вследствие острого внутрисосудистого гемолиза, массивность которого определяет степень анемии. Последняя, как известно, усугубляется патологическим депонированием и возможной геморрагией. В результате уменьшения ОЦЭ снижается кислородная емкость крови и ее кислородно-транспортная функция.
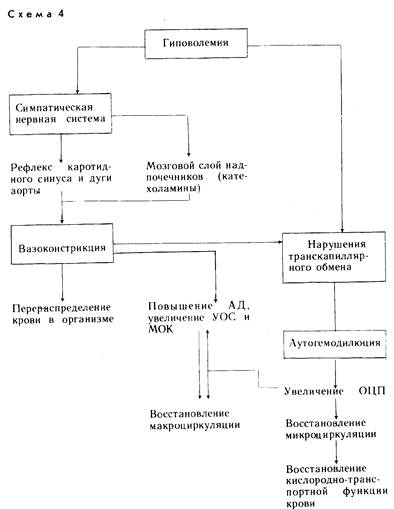
Реакции защиты и адаптации направлены главным образом на восстановление и поддержание центральной и периферической гемодинамики, так как при развитии ожогового шока они страдают в первую очередь и в наибольшей степени (схема 4).
Нормализация волемии и восстановление ц ентральной г емодинамики. Для обеспечения жизнедеятельности организма защитно-приспособительные реакции направлены в первую очередь на восстановление безопасного уровня артериального давления. Гипотония при ожоговом шоке — результат двух последовательно проявляющихся факторов: вначале острая
дилатация сосудов (центрального происхождения), вызывающая относительную гиповолемию, а затем постепенное, но за короткий срок снижение; ОЦК в результате плазмореи и гемолиза — абсолютная гиповолемия.
Соответственно развиваются реакции защиты и компенсации. Вначале происходит спазм сосудов — вазокон-стрикция, в результате чего ликвидируется опасное несоответствие емкости сосудистого ложа иОЦК. В этой реакции активное участие принимает симпатическая нервная система, которая способствует активному выделению в кро-воток из мозгового слоя надпочечников больших количеств катехоламинов. Кроме того, в реакции вазоконстрикции активное участие принимают хеморецепторы каротидного синуса и дуги аорты, чутко реагирующие на острую гиповолемию.
На фоне повысившеюся периферического сопротивления сосудов улучшается центральная гемодинамика, увеличиваются УОС и МОК [Селезневе. А., 1971]. Кроме того, происходит перераспределение крови, ее централизация для обеспечения кровоснабжения жизненно важных органов — головного мозга и сердца.
Восстановление м икроциркуляции и нормализации т ранскапиллярного обмена. На уровне микроциркуляции возникает другая исключительно важная для жизнедеятельности организма защитно-приспособительная реакция, имеющая в итоге универсальный характер, — аутогемодилюция. Во-первых, она направлена на ликвидацию гиповолемии за счет увеличения плазменного компонента ОЦК. Во-вторых, улучшая реологические свойства застойной и вязкой крови, она нормализует транскапиллярный обмен, в частности белковый, водно-солевой и кислородный.
Механизм этой транскапиллярной реакции заключается главным образом в том, что в интерстициальной жидкости, пополнившейся солями и низкодисперсными белками плазмы крови, резко повышается гидростатическое давление. В это же время в крови оно снижается и ток жидкости направляется обратно из интерстиция в сосудистые пространства. В результате происходят гидремия крови и снижение вязкости.
Количество фильтрующейся жидкости может достигать значительных объемов, особенно при отеке тканей (1,5л и более).
Нормализация кислородного обмена вслед за увеличением ОЦП происходит как за счет ускорения капиллярного кровотока, так и увеличения ОЦЭ, пополнившегося дезагрегированными эритроцитами, т.е. за счет увеличения общей кислородной емкости крови, способной обеспечить транспорт и отдачу тканям необходимого количества кислорода.
Однако эти защитно-приспособительные реакции — вазоконстрикция и аутогемодилюция — в экстремальной ситуации сами по себе не могут ликвидировать гиповолемию и восстановить нарушенную гемодинамику. В большинстве случаев для борьбы с явлениями ожогового шока приходится применять мощную интенсивную инфузионную терапию.
Клинические проявления в значительной мере зависят от глубины и распространенности термического поражения, т.е. от степени ожога.
Ожоговый шок развивается лишь при ожоге II (пузыри), III (некроз кожи) и IV (некроз подкожных тканей) степени и распространенности поражения в пределах не менее 10—15% поверхности тела.
В первые 1—2 ч ожоговый шок проявляется беспокойством пострадавшего, часто значительным возбуждением (эректильная фаза). Затем в течение 1—2 сут пострадавший находится в состоянии заторможенности, апатии, ступора, депрессии (торпидная фаза).
Кожные покровы бледные, появляется холодный пот, дыхание поверхностное, артериальное давление снижено. Гипотония может длиться 12—15ч, а в ряде случаев, несмотря на лечение, до 2 сут. При термическом поражении дыхательных путей возникают серьезные нарушения вентиляции. В дальнейшем может развиться отек легких, ателектазы.
На первых порах острая гиповолемия не всегда сопровождается гипотонией, что в некоторой степени может маскировать развитие ожогового шока [Кочетыгов Н. И., 1973].
В равной мере замаскированной может оказаться и глубокая анемия, вызванная гемолизом, депонированием, кровоточивостью. Это может иметь место в тех случаях, когда определяют концентрационный показатель содержания гемоглобина в крови на фоне значительной гемоконцентрации, вызванной массивной плазмореей. В результате этого гематокрит, как и содержание гемоглобина в единице объема плазмы, оказывается завышенным.
На почве острого массивного внутрисосудистого гемоли-за и нарушения функции почек в моче могут наблюдаться значительные изменения. Плотность мочи может возрасти до 1060, в ней содержится большое количество белка, сахара, эритроцитов, свободного гемоглобина (гемоглобинурия).
Трансфузионная терапия базируется главным образом на механизме защитных реакций организма на ожоговую травму. Она должна быть направлена на поддержание, усиление и пролонгирование этих защитно-приспособи-тельных реакций до момента полного восстановления нарушенных функций организма.
В задачи трансфузионной терапии ожогового шока должны входить мероприятия, имеющие целью не только механическое восполнение недостающих компонентов крови (в том числе белков, эритроцитов, воды и др.), но и регуляцию и коррекцию ее коллоидно-осмотических, белково-волемических, реологических и других свойств: 1) восстановление центральной гемодинамики путем восполнения недостающего О ЦК и устранение гиповолемии; 2) восстановление микроциркуляции путем нормализации реологических свойств крови; 3) нормализация транскапиллярного обмена путем восполнения дефицита белков крови, компенсации дефицита интерстициальной жидкости, коррекции солевого состава крови.
Выбор необходимых трансфузиои-н ы х с р е д с т в должен быть основан на механизме их действия и соответствовать задачам инфузи-онного лечения ожогового шока. В расчет следует принимать также возможное побочное действие препаратов, т.е. оценивать все их положительные и отрицательные стороны.
Восполнение дефицита ОЦК. Необходимо использовать средство, которое обладало бы длительным гемодинамическим действием. Более всего этому требованию отвечают коллоидные растворы, молекулярная масса которых в основном превышает почечный порог фильтрации, что позволяет им длительно циркулировать в кровеносном русле. Таким средством является полиглюкин. Он оказывает длительное гемодинамическое действие, является хорошим заполнителем сосудов, быстро купирует гиповоле-мию. Восстанавливая ОЦК, он увеличивает УОС и МОК. Вливанием полиглюкина можно быстро повысить артериальное давление и вывести пострадавшего из состояния шока.
Высокоэффективной коллоидной средой гемодинамиче-ского действия является и донорская плазма. Однако ее применение требует учета групповой принадлежности крови донора и реципиента, так как при массивной трансфузии может произойти реакция групповой несовместимости. Кроме того, при использовании плазмы есть опасность переноса вируса гепатита В, особенно при массивной трансфузии. Возможно также развитие синдрома гомологичной крови.
Переливание цельной консервированной донорской крови для восполнения дефицита ОЦК не представляется целесообразным. Помимо того что для ее применения необходимо предварительно произвести весьма трудоемкие и ответственные исследования крови донора и пострадавшего на групповую совместимость, она имеет ряд отрицательных свойств, ограничивающих ее использование при ожоговом шоке. В первую очередь следует отметить ее высокую вязкость и содержание в ней микросгустков, что при высокой гемоконцентрации в результате обильной плазмореи может усугубить глубокие нарушения микроциркуляции у пострадавшего. Кроме того, переливание закисленной цитратной крови в больших дозах на фоне ожоговой интоксикации может иметь тяжелые последствия, так как опасно развитием синдрома гомологичной крови. Следовательно, переливание цитратной крови с целью лишь устранить гиповолемию не только не является методом выбора, но и способно усугубить расстройство капиллярного кровотока.
Восстановление м икроциркуляции. Гемоконцентрация, явившаяся причиной нарушения микроциркуляции и реологических свойств крови, т.е. повышенной вязкости и потери текучести, может быть ликвидирована только инфузионной гемодилюцией. Для разведения крови необходимы жидкости, обладающие низкой вязкостью.
В качестве гемодилютантов широко используют калло-идные низкомолекулярные растворы, способные активно разжижать застойную сгущенную кровь и восстанавливать ее реологические свойства. Такими гемодилютантами являются реополиглюкин и желатиноль. Их механизм действия заключается не только в том, что они восполняют недостающий ОЦК и разжижают кровь, но и привлекают в капиллярное русло жидкость из интерстиция. Этот механизм действия указанных препаратов усиливает и пролонгирует защитную реакцию организма — аутогемоди-люцию.
Изучая у обожженных больных в состоянии гиповолемического шока действие низкомолекулярного коллоидного (декстран) кровезаменителя реомакродекса, L. Е. Gelin (1962) визуально наблюдал механизм его действия. Бинокулярная луна, увеличивающая объект исследования почти в 1000 раз, позволяет видеть, фотографировать или снимать на кинопленку ток эритроцитов в капиллярном русле бульбарной конъюнктивы глаза больного, нс прибегая к каким-либо оперативным вмешательствам или манипуляциям. Автор обнаружил, что при вливании в кровоток больного реомакродекса застойные эритроциты начинают сначала совершать колебательные движения, а затем дезагрегируют и восстанавливают нормальный кровоток, имеющий поступательный, ламинарный характер. Дезагрегация эритроцитов не происходила лишь тогда, когда ожоговый шок был необратимым и в капиллярном русле из эритроцитных скоплений образовывались сгустки («сладж»). Даже в тех случаях, когда артериальное давление удавалось повысить вливанием макродекса, микроциркуляция не восстанавливалась.
Высокоактивным реологическим препаратом, восстанавливающим микроциркуляцию, является 5—10% раствор альбумина. Его гемодинамический механизм основан на привлечении жидкости из интерстициальных пространств в сосудистое русло. Этим достигается увеличение ОЦК. Не менее важно наступающее разжижение крови, вымывание в кровоток застойных агрегированных эритроцитов и восстановление реологических свойств крови. Альбумин особенно показан при отечности тканей, так как обладает высокой гигроскопичностью. Его нельзя применять при дефиците ОЦЖ в организме. В отличие от плазмы альбумин не переносит вирус гепатита В.
Нормализация транскапиллярного обмена. Для восполнения белков плазмы, утерянных в основном в результате обильной плазморреи, а также переместившихся в интерстициальные пространства при нарушенном транскапиллярном обмене, показано переливание белковых препаратов. Оптимальным средством представляется нативная плазма, сохранившая в своем составе весь спектр естественных белков. Переливание свежезаготовленной нативной плазмы может быстро и наиболее полноценно возместить потери различных видов белка. В равной мере может быть использована высушенная или лиофилизированная плазма, хотя в ней отмечаются потери некоторого количества отдельных видов белка. Однако ни один из этих видов плазмы, различающихся по методу заготовки и хранения, не лишен возможности переноса вируса гепатита В и потому небезопасен.
Использование альбумина с целью возмещения абсолютных потерь циркулирующего белка представляется менее эффективным, так как он содержит ограниченный спектр белков и не может восполнить дефицит остальных видов, не менее важных для организма.
С позиций возмещения белковых потерь можно считать более показанным переливание 4,8% раствора протеина, содержащего и альбумины и глобулины. Содержание большого спектра белков в достаточно большом объеме жидкости определяет выбор этого препарата. Он, как альбумин, подвергается пастеризации и свободен от вируса гепатита В.
Нормализация в о д н о-с о л е в о г о о б-м е н а заключается главным образом в восстановлении объема интерстициальной жидкости, значительная часть которой проникает в сосудистое пространство для поддержания ОЦК как вследствие естественной реакции аутогемодилюции, так и в результате инфузии плазмозаменителей. При массивной потере жидкости организмом через ожоговую поверхность восполнение ее интерстициальной части служит профилактикой опасного обезвоживания клеточного сектора. От своевременного восполнения дефицита ОЦЖ и восстановления равновесия между его секторами (клеточным, интерстициальным и внутрисосудистым) зависит обратимость ожогового гиповолемического шока.
Для эффективного выполнения задачи вливаемая в организм жидкость должна обладать свойством легко проникать в интерстициальные пространства и содержать ионы натрия. Принципиально этим требованиям отвечает изотонический раствор хлорида натрия. Однако он не полностью соответствует составу интерстициальной жидкости, содержащей ионы калия, кальция и др. В большей мере показаны вливания эквилибрированного электролитного раствора Рингера, содержащего эти ингредиенты. Могут быть использованы раствор Локка и др.
При выборе инфузионных средств кристаллоидной терапии следует исходить из характера нарушений водно-солевого баланса в организме.
При нарушениях, связанных с внеклеточной дегидратацией, т.е. с недостатком натрия во внеклеточной жидкости, что имеет место в развитии ожогового шока, показано одновременное вливание гипертонического раствора солей натрия и 30% раствора мочевины (из расчета 1 г сухого вещества на 1 кг массы тела). Последняя хорошо выводит из организма воду и концентрирует натрий.
При внеклеточной гипергидратации и избыточном содержании натрия показано вливание бессолевых жидкостей, в частности изотонического раствора глюкозы и 20% раствора маннитола (из расчета 1 г сухого вещества на 1 кг массы тела), способствующего выведению натрия из организма. Кроме того, можно использовать препараты, лишенные натрия, — трис-буфер и ТНАМ (гидрометил).
Однако при использовании мочевины, маннитола, трис-буфера и ТНАМ следует помнить об их побочном действии, в результате которого может возникнуть или усилиться гипотония как результат усилившегося осмотического диуреза.
На почве термического поражения скелетных мышц часто возникает гиперкалиемия. Она свидетельствует о клеточной гипергидратации, т. е о замещении калия натрием. В таких случаях выбор падает на растворы, содержащие ионы натрия, которые следует вливать в сочетании с 40% (гипертоническим) раствором глюкозы и инсулином (последний из расчета 1 ЕД на 1—3 г сухого вещества глюкозы). Имеются данные о том, что глюкоза стимулирует накопление в тканях организма ионов калия.
Коррекция кислотно-щелочного состояния. Возникающий при ожоговом шоке метаболический ацидоз часто усугубляется дыхательными расстройствами на почве термического поражения воздухоносных путей и нарушения внешнего дыхания. Показанием к коррекции кислотно-щелочного состояния является снижение стандартного бикарбоната натрия в сыворотке крови пострадавшего до 16—17 ммоль/л (при норме 24 ммоль/л).
С этой целью применяют 4,8% раствор бикарбоната натрия из расчета (по формуле Аструпа): 0,3 х масса тела (кг)х (-BE). Можно использовать лактат натрия, окисляющийся до СО а и НаО, но действующий более медленно. В настоящее время широко применяют новый препарат — лактасол.
Успешному восстановлению кислотно-щелочного состояния способствует нормализация центрального и периферического кровообращения, а также транскапиллярного обмена, в частности белкового и водно-солевого. Однако немаловажное значение имеет профилактика интоксикации, отчетливо проявляющейся лишь к концу I периода (ожого-вый шок) и началу II периода (интоксикация) ожоговой болезни. С этой целью может быть использован высокоактивный дезинтоксикационный коллоидный препарат низкомолекулярного поливинилпирролидона — гемодез. Его высокая клиническая эффективность определяется способностью образовывать с токсинами химические комплексы, лишенные токсичности. Препарат легко проходит через почечный барьер и вместе с инактивированными токсинами выводится с мочой. Благодаря разветвленности молекулярных цепей гемодез быстро вступает в связи с токсинами и клинический эффект оказывается незамедлительным.
Своевременная коррекция кислотно-щелочного состояния и дезинтоксикация организма являются хорошей профилактикой развития острой п очечной недостаточности (ОПН). Для усиления этого эффекта можно использовать мочевину и маннитол, угнетающие канальцевую реабсорбцию воды и улучшающие клубочковую фильтрацию.
На ранних стадиях развития ожогового шока потери абсолютного количества циркулирующих эритроцитов (гемолиз, кровотечение) относительно невелики. В связи с этим, несмотря на уменьшение кислородно-транспортной функции крови вследствие гемоконцентрации и нарушений микроциркуляции, в большинстве случаев нет прямых показаний к переливанию крови. Лишь после проведения гемодилюционной терапии и восстановления макро- и микроциркуляции может потребоваться коррекция анемии. Как и при других патологических состояниях, применение донорских эритроцитов показано при содержании гемоглобина ниже 80—100 г/л и гемато Крите более 0,25 г/л. В этих случаях предпочтительнее вводить эритроцитную массу после предварительного вливания реологически активных препаратов.
Объем и темп трансфузи онно и терапии. Продолжительность трансфузионной терапии, как и ее объем, зависит от степени ожога, его распространенности, выраженности патологических сдвигов в организме, активности защитно-приспособительных реакций и, конечно, эффективности применяемого лечения.
Главным критерием выбора объема и темпа трансфузионной терапии служат показатели гемодинамики и почасового диуреза. Наряду с подсчетом частоты и оценкой качества пульсовой волны, измерениями максимального и минимального АД важное диагностическое значение имеет определение уровня ЦВД. Этот показатель весьма чувствителен к гипо- и гиперволемии, централизации кровообращения и т.д. Не менее ценным показателем является почасовой диурез. В норме он составляет 1 мл/(кг • ч). При форсированном диурезе он становится равным 1,5—2 мл/(кг. ч), т.е. увеличивается в Г/а—2 раза.
Нарушения функции почек тесно связаны с развитием в организме пострадавшего гиповолемии, снижением УОС и МОС, падением сосудистого тонуса и другими нарушениями, не корригирующимися компенсаторными механизмами саморегуляции. В результате по данным измерения почасового диуреза (его повышения или снижения) можно вполне достоверно судить об адекватности трансфузионной терапии, регулировать ее объем и темп проведения.
Чрезвычайно важно подчеркнуть, что ожоговый шок характеризуется большими потерями жидкости, адекватное восполнение которых является залогом успеха всей терапии в целом. Имеются различные методы математического вычисления объема дефицита жидкости. Наиболее простой из них основан на использовании показателя гематокрита:

где ОЦК — определяемый по номограмме (мл); гемато-крит (1) — норма; гематокрит (2) — измеренный.
В 1 -е сутки ожогового шока жидкость вводят из расчета 1 мл х 1 % площади ожога х 1 кг массы тела. Большинство авторов [Муразян Р. И., 1973; Жижин В. Н. и др., 1979, и др.] предлагают в 1-е сутки ожогового шока вводить коллоидные и кристаллоидные растворы в объеме от 1,5 до 6 л или несколько более, а на 2-е сутки еще 50—100% от объема, введенного в 1-е сутки, в зависимости от степени ожогового шока и эффективности трансфузионной терапии, как это представлено в приводимой ниже программе.
Программа трансфузионной терапии ожогового шока, применяемая в Ожоговом центре ЦНИИГПК Министерства здравоохранения СССР
| Гижгсть ок;|: от легкого до крайне тяжелого | ||
| 1 2 f сутки | ||
| M:iKI'll\l\ М,;[ | ||
| Коллоидные растворы | ||
| Плазма (нативная, сухая) | 0,8 1,2 | 0,0—0,6 |
| Полиглюкин | 0,8-1,6 | 0,4 1,6 |
| Реонолиглюкин | 0,8-v 1,6 | 0,8-0,8 |
| Гемодез (полидез) | 0,6—0,8 | 0,2 0,6 |
| Кристаллоидные и другие рас | ||
| творы | ||
| Солевые | 0,8-3,0 | 0,4—1,2 |
| Глюкоза | ||
| Бикарбонат натрия (4,8%) | 0,2—1,0 | 0,2-0.8 |
| Лактасол | 0,8--0,4 | 0,8-0,8 |
| Маннитол (20%) | 0,2 1,0 | 0,2—0,6 |
| Новокаин (0,1%) | 0,4 0,6 | 0,4 0,4 |
| Всего | 5,4—11,6 | 3,4—7,4 |
Исходя из всего сказанного можно схематизировать лечение ожогового шока и составить его программу в зависимости от тяжести повреждения (табл. 4).
Приведенные рекомендации показывают, что лечение ожогового шока требует обширных знаний в области инфузионной терапии. Разнообразие и большие объемы инфузионных препаратов могут дать положительный эффект только при грамотном их применении и тщательном контроле за состоянием пострадавшего. На современном уровне знаний и возможностей летальность при ожоговом шоке составляет 6—8%.
Таблица 4. Программа трансфузионной терапии ожогового шока (1—2-е сутки) (минимальные дозы)
| Тр;1НГф\- 11101111.1Я С[)ГД;1 | ,-п.,.„ь,н^>^,.,..тц | |||||
| •I Ч-k | гя/кс.-шя | кр.жп,- | ||||
| тяжг.^я | ||||||
| ,, ^ | 1 f | 2-г | 1-f | 2^ | ||
| ГУТКН | емки | (.•VI К 11 | fVTKII | Г\ТК11 | сутки | |
| Поли глюки и Раствор новокаина 0,0125% Лактасол | 400 200 400 | 200 400 | 800 100 400 | 800 100 400 | 800 200 400 | 800 200 400 |
| Реонолиглюкин Плазма (сухая, нагинная) Глюкозосолевые растворы | 400 400 | 400 400 400 | 400 200 400 | 400 400 800 | 400 200 400 | |
| Раствор гидрокарбоната нат рия 4% Маннитол 20% Гемодез (нолидез) | 200 200 | 300 200 200 | 400 400 400 | 400 200 200 | ||
| Общий объем и н фузии |
Глава IV ТРАНСФУЗИОННАЯ ТЕРАПИЯ ОСТРЫХ ЗАБОЛЕВАНИИ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ
Острые заболевания брюшной полости, как правило, требуют неотложной хирургической помощи, и лишь некоторые из них могут быть излечены с помощью консервативной терапии. Панкреатит, перитонит и кишечная непроходимость развиваются подчас так стремительно, что в течение нескольких часов способны вызвать грубые' расстройства гомеостаза, ставящие организм на грань жизни и смерти. Даже после устранения первопричины острого живота возникшие нарушения могут прогрессировать. Иногда при таких состояниях трансфузионная терапия становится средством реанимации. Своевременная и рациональная коррекция нарушений внутренней среды организма часто играет такую же роль, как и хирургическое вмешательство. Успех этого лечения во многом зависит от правильного понимания патогенеза заболевания, четкого распознавания клинических фаз его развития и механизма действия трансфузионных средств.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1550; Нарушение авторских прав?; Мы поможем в написании вашей работы!