
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Обоснование трансфузионнои программы при искусственном кровообращении
Бурное развитие сердечно-сосудистой хирургии во многом зависело от успехов современной трансфузиологии, позволившей внедрить в практику метод искусственного кровообращения.
Кроме чисто инженерных проблем, в частности конструкции АИК (система сердце — легкие), изучались проблемы циркуляции и газотранспортной функции применяемой крови.
Многие вопросы, касающиеся, в частности, донорской крови, были решены после того, как метод искусственного кровообращения уже был внедрен в практику операций на открытом сердце и крупных магистральных сосудах. Вначале обсуждался вопрос о профилактике свертывания крови при ее циркуляции в системе аппарат — больной. Он был решен сравнительно легко путем выбора необходимой дозы гепарина, вводимой в кровь, вливаемую в аппарат, и в циркулирующую кровь больного. Затем возник вопрос о допустимости применения для заполнения АИК донорской нитратной декальцинированной крови. Большой вклад в разрешение этой проблемы внесла школа Б. В. Петровского, показавшая возможность применения нитратной крови при осуществлении искусственного кровообращения. Заготовка крови для заполнения АИК стала осуществляться в основном с помощью цитратного раствора (ЦОЛИПК-76 и др.), что обеспечивало хорошую сохранность консервированной крови более чем на сутки. При заготовке крови на гепарине, обладающем слабыми стабилизирующими свойствами, кровь может храниться не более 1 сут, после чего в ней образуются большие сгустки.
По мере применения искусственного кровообращения при операциях на открытом сердце стали обращать на себя внимание осложнения, препятствующие дальнейшему успешному развитию этого метода. Как потом выяснилось, они были связаны с использованием крови, заготовленной от большого числа доноров (10—20 и более) с различным фенотипом, вызывающим иммунобиологическую пллзмен-но-белковую несовместимость. Авторы [Dow I. W. 2t al., 1959], впервые обнаружившие эти осложнения в экспериментах на собаках при изучении метода искусственного кровообращения, назвали их синдромом гомологичной крови.
Углубленное изучение сложной проблемы искусственного кровообращения в условиях клиники было осуществлено совместными усилиями коллективов ЦНИИГПК и Института сердечно-сосудистой хирургии имени А. Н. Бакулева АМН СССР, начатыми еще в 1967 г. Материалы исследований описаны нами ранее [Рудаев Я. А., 1971].
Исследования показали, что синдром гомологичной крови — это прежде всего «парадоксальная» гиповолемия, которая фатально не поддается купированию, несмотря на массивные или даже сверхмассивные переливания донорской крови. Как удалось установить, причиной этого явления служит «транзиторное» депонирование гомологичной донорской крови в организме больного.
Исследования в области патогенеза синдрома гомологичной крови позволили нам продолжить изучение различных методов его профилактики при лечении острой операционной кровопотери [Климанский В. А., Рудаев Я. А., 1979]. Имея определенный опыт в изучении этой проблемы, мы считаем наиболее эффективными методы профилактики гиповолемического синдрома гомологичной крови, направленной главным образом на уменьшение плазменно-белковой несовместимости. С этой целью могут быть рекомендованы:
1) сокращение объемов переливания донорской крови в пределах 30—60% объема кровопотери и не более 50% исходного ОЦК больного, т.е. не более 2—2,5 л для взрослого;
2) обязательное использование метода гемодилюции как при заполнении рабочей емкости АИК, так и при замещении операционной кровопотери, в связи с чем объем вводимых коллоидных растворов должен превышать последнюю на 40—60%;
3) использование аутокрови — «аппаратной» или заранее заготовленной в предоперационном периоде;
4) применение донорских эритроцитов, тщательно отмытых от факторов плазмы, — свежезаготовленных или размороженных, в сочетании с альбумином или собственной плазмой больного (аутоплазма).
Заполнение рабочей емкости АИК. Рабочая емкость АИК может быть различной в зависимости от принципа работы оксигенатора. Первые АИК были рассчитаны на
^л^У^=^^
доноров. В сочетании с вн^гривеннь8.0"3^"'" (п0 200 м- ' ^^S;^-??^^^^
^==s£S?^^^^^^^^^ =^rro^5Z^^^
шить исходы оперативных вмр3" ""'"""•""но УВД сердце;условиях и^у^нн^к^оХ^ниГ^1™'
———.р^за^^^^^
исполь^Т^оТь "за^т^Г6""" крови- для "^и" стабилизированную гепаоТноТ^ от «<хколъких доноров.
"ором ЦОЛЙПК-76 р ^^л^кТ^030""^™"" рас ontS-<^^^^
^ня.^Т-^ "S= ——р
.ем: а) гепаринизированная кровь -i^l's1"" ^ "озже ^овленна^на атворах ЦОЛИПК^, 'ЫпГЙ
использована кров^-Зсут^нТян^'43^ может быть растворе, хранения на глюкозоцитратном
При проведении перйуэии v пп-v» по следует применять донорскун™кюв^ ^ ° ^Р^та помощью гепарина ^ ' "^чяизированную с
Подготовка крови к звпо тенит А мк- гг
подготовленная для заполнения™^ K^ онорская ^овь,
вать крови больного по гругпам АВ^'" ^ соответств0-
^H-pZ^xd^^^^ -^г^^^^^^^^^
UHTp^b^pT^Z^B^Sb^T"6""08 на —————30-
^^Т^Гна^^^ -ьцня соот^тствепнТр^т^ ^ал^^ ^ата3
яатрия (реконверсия). Независимо от состава консерванта деред перфузией необходимо произвести коррекцию кислот-
•ио-щелочного состояния крови в аппарате путем добавления к ней раствора бикарбоната натрия или другого буферного раствора под контролем показаний рН, BE и др.
Перед применением кровь должна быть подогрета до температуры тела больного путем рециркуляции ее в системе теплообменником.
Разведение крови (гемодилюция), предназначенной для заполнения АИК. Заполнение АИК исключительно цельной донорской кровью в значительной мере затрудняло проведение перфузии. Это было связано с тем, что происходило сгущение циркулирующей крови, в результате чего повышались ОПС и капиллярное кровообращение резко затормаживалось. Снижение скорости капиллярного кровотока влекло
- за собой агрегацию форменных элементов крови, в частности эритроцитов и тромбоцитов, их депонирование и выключение из циркуляции. В дальнейшем развивались микротромбоз, шунтирование капиллярного кровотока, нарушения транскапиллярного обмена и т.д. — все те изменения, которые наблюдаются при развитии синдрома гомоло-гичной крови.
С целью уменьшения объемов цельной донорской крови, заливаемой в АИК, группа шведских ученых (В. Ingelmann, L. Gelin и др.) в 1961 г. предложила использовать в качестве гемодилютанта реомакродекс — коллоидный раствор низкомолекулярной (30 000—40 000) фракции декстрана, обладающий низкой вязкостью и высокой реологической активностью. Результатом явилось улучшение исходов общей перфузии, снижение числа осложнений, связанных с синдромом гомологичной крови, чему способствовали два фактора:
уменьшение объема цельной донорской крови, заливаемой в АИК, и разжижение крови, циркулирующей в системе аппарат — больной. С этой же целью в Советском Союзе стали применять желатиноль, а с 1967 г. — реополиглю-кин.
Применение реополиглюкина в качестве гемодилютанта способствовало сокращению объемов цельной донорской крови с 4,5 до 2,7 л при использовании АИК с тем же объемом заполнения [Киселев А. Е. и др., 1969].
АИК заполняют реополиглюкином из расчета 20—40 мл/кг, что обусловливает общее разведение донорской крови на 20—30%. В результате такой гемодилюции предотвращаются механическая травма крови (гемолиз), тромбоцитопения, гипофибриногенемия и постперфузионные кровотечения, связанные с гипокоагуляцией после нейтрализации гепарина протамина сульфатом.
Депонирование крови во время перфузии при заполнении АИК цельной донорской кровью составляет в среднем 6,7% первичного объема, а при разведении ее реополиглюкином на 20—30% — всего 2%. Следовательно, разведение донорской крови реополиглюкином в АИК до начала общей перфузии предупреждает развитие синдрома гомологичной крови в процессе проведения искусственного кровообращения.
Рекомендованный нами в практику искусственного кровообращения реополиглюкин вполне себя оправдал и при использовании АИК с малым объемом заполнения (1,5—2 л) может быть единственным заполнителем без применения цельной донорской крови у больных с большим ОЦК и высоким содержанием гемоглобина и белка в крови.
Для осуществления «управляемой гемодилюции» [Филатов А. Н., Баллюзек Ф. В., 1972], предусматривающей своевременную коррекцию избыточного разведения крови путем выведения излишков жидкости, оптимально использование желатиноля, легко поддающегося действию диуре-тиков. Гемодилюция в пределах 20—30% в определенной мере служит методом профилактики синдрома гомологичной крови, способствующим улучшению капиллярного кровообращения при общей перфузии.
Кроме применения реополиглюкина, с целью уменьшения объема цельной донорской крови для заполнения АИК нами предложено использовать размороженные донорские эритроциты, свободные от иммуноагрессивных факторов плазмы [Я. А. Рудаев и др., 1969]. Затем в США для заполнения АИК стали применять размороженные эритроциты, хранившиеся при умеренно низкой температуре (-80°Q [Valeri, 1970].
Для заполнения АИК донорскими эритроцитами, хранившимися в жидком азоте, а затем подвергнутыми оттаиванию (размораживанию) и тщательному многократному отмыванию от ограждающего раствора (глицерина), детрита и плазменных факторов, создан специальный перфузат (авторское свидетельство № 1388922, 1969 г.), включающий следующие ингредиенты:
| Донорские эритроциты, размороженные и отмытые, разведенные в растворе ЦОЛИПК-86 (гемоглобин 130--150 г/л, гематокрит 0,40-0,50 л/л) Реополиглюкин 25% раствор альбумина | 40-50% 15 25% 10--15% |
| 15% раствор маннитола 5% раствор эпсилон-аминокапроновой кислоты 4% раствор бикарбоната натрия 10% раствор хлорида кальция 2% раствор хлорида калия Кокарбоксилаза 5% раствор витамина С 5% раствор» В, 5% раствор» Be Инсулин | 3-7% 2-3% 5-10% 0,5-1,0% 0 г» 1 °/ u,o i /о 40-50 мг/л 5 10 мл 2—4 1—2 4-6 ЕД/л |
Объем заполнения АИК перфузатом может составлять 3—4 л при длительности перфузии 60—90 мин в условиях нормо- или гипотермии.
Оказавшийся в надетое эритроцитной массы, хранившейся после размораживания и отмывания до момента употребления в АИК при температуре 4°С в течение суток, свободный гемоглобин в количестве в среднем 1460 ±180 мг/л практического значения в отношении развития острой почечной недостаточности не имеет. Это объясняется тем, что, во-первых, концентрация свободного гемоглобина в системе аппарат — больной резко падает и составляет в среднем 250+20 мг/л, во-вторых, в надетое нет детрита, в-третьих, свободный гемоглобин легко поглощается в крови больного гаптоглобином и ретикулоэндотели-альной системой.
По мере заполнения оксигенатора АИК перфузатом шиловидные формы эритроцитов исчезают и все клетки складываются в монетные столбики. В них сохраняется концентрация фосфорных фракций гемоглобина, в частности АТФ и 2,3-ДФГ, ответственных за форму и эластичность мембраны эритроцита, а также за способность отдавать кислород тканям организма. В эритроцитах сохраняется концентрация калия и натрия. После общей перфузии эритроциты продолжают циркулировать в крови реципиента в течение 20—26 сут.
Одним из методов профилактики синдрома гомологичной крови при заполнении АИК может служить использование аутоплазмы, заготовленной в больших объемах методом плазмафереза. Если к ней добавить донорские размороженные и тщательно отмытые эритроциты, то получится цельная кровь, лишенная иммунобиологической агрессивности по отношению к реципиенту.
В последние годы много внимания уделяют методу заготовки собственной крови больного в предоперационном периоде. Однако все известные методы накапливание аутокрови небезразличны для организма больных-доноров. Длительная заготовка аутокрови, необходимой в большш количествах для заполнения АИК, сопряжена с ее «старени ем». Одномоментная заготовка в больших объемах опасна для больных. Различные методы «обменной» заготовки аутокрови, т.е. путем возврата ранее взятой дозы крови и обмен на новую, но в большем объеме, также требуют 07 организма напряжения адаптационных механизмов центральной гемодинамики, в частности МОС. Для кардиохи рургического больного это является излишней нагрузкой на сердце.
Следовательно, все эти методы не могут быть приняты безоговорочно.
Заготовка эритроцитов из аутокрови (аутоэритроцитов) путем их выделения из цельной крови больного с последующим длительным хранением в жидком азоте также себя не оправдывает из-за больших потерь, происходящих в результате гемолиза при каждой манипуляции в объеме не менее 5% (эксфузия, стабилизация, сепарирование, глицери-низация, ультрабыстрое замораживание, оттаивание, трехпятикратное отмывание — центрифугирование, хранение в течение суток при 4°С и т.д.).
Одним из средств для заполнения АИК, способных предотвратить осложнения, связанные с синдромом гомоло-гичной крови, является использование фибринолизной (када-верной) крови. Ее преимущество в том, что она не требует стабилизатора, а главное ее можно заготовить в большом количестве от одного или двух доноров. Однако сложности, с которыми приходится сталкиваться при ее заготовке от трупов, а тем более трудности подбора для каждого больного резко ограничивают возможности развития этого метода. Попытка длительного накапливания больших количеств фибринолизной крови путем ее долгосрочного хранения с.помощью ультрабыстрого замораживания в жидком азоте не облегчает решение проблемы в целом.
Замещение постперфузионной и постоперационной кровопотери. Постперфузионный период характеризуется повышенной кровоточивостью на почве искусственной гемофилии, создаваемой во время перфузии введением в АИК и в организм больного достаточно больших количеств гепарина. Для нейтрализации избыточного количества гепарина в крови показано вливание протамина сульфата в соотношении 1:1, а при продолжающейся повышенной кровоточивости в соотношении 2:1. Основными показателями адекватности введения протамина сульфата служат тромбиновое время и результаты титрования крови протамина сульфатом.
Другими причинами повышенной кровоточивости в постперфузионном периоде могут быть тромбоцито-пения, гипо- или афибриногенемия, повышенная фибрино-литическая активность.
При тромбоцитопении, связанной с искусственным кровообращением, показано переливание свежезаготовленной тромбоцитной массы или антигемофильной плазмы, оказывающей положительное влияние на гемостаз.
В случае развития гипо- или афибриногенемии в результате длительной или неадекватной перфузии следует применять фибриноген в больших дозах (4—12 г). Однако перед инфузией фибриногена следует ввести ингибиторы фибринолитической активности с целью пролонгирования его действия. Это особенно необходимо при повышенной фибринолитической активности. Для ее подавления внутри-венно вводят 100—200мл 6%, раствора эпсилон-аминокап-роновой кислоты, 25—50 ЕД трасилола или других препаратов, являющихся ингибиторами фибринолитической активности крови.
Для активирования сосудистого компонента свертывающей ^системы крови, с которым тесно связана функциональная агрегационная активность тромбоцитов, показано вливание дицинона в дозе 500—1000 мг, желательно после переливания тромбоцитной массы.
Вторичные нарушения гемостаза могут возникнуть в раннем постперфузионном периоде в результате неадекватной нейтрализации гепарина протамином сульфата, недостаточности кровообращения на почве некупированной гиповолемии, нарушения кислотно-щелочного состояния организма, микротромбообразования (ДВС) и т.д.
В развитии этого осложнения определенную роль могут играть избыточные массивные трансфузии консервированной донорской крови, в значительной мере превышающие объем операционной кровопотери. Массивные гемотрансфу-зии служат причиной развития синдрома гомологичной крови, одним из проявлений которого является повышенная кровоточивость. Для профилактики осложнений, связанных^ с массивными вливаниями донорской крови, не следует замещать кровопотерю по принципу «капля за каплю» или тем более с превышением на 20—30%.
Операционная кровопотеря должны быть замещена цельной донорской кровью не более чем на 30—60%, т.е. частично. Кроме того, следует использовать коллоидные кровезаменители в дозе, превышающей кровопотерю на 40—60%. Такая тактика способствует разведению крови и предотвращает развитие синдрома гомологичной крови. Разжижение крови больного путем массивных вливаний кровезаменителей способствует восстановлению кровотока в застойных капиллярах и выбросу этой крови в общий кровоток (экспонирование крови), что при значительных инфузиях коллоидных растворов может составить 20—25% исходного ОЦК. Поступление в общий кровоток аутокрови, содержащей факторы свертывания, способствуют эффективному купированию геморрагического диатеза в постперфузи-онном и постоперационном периодах.
Использование коллоидных кровезаменителей, в частности полиглюкина для восстановления ОЦК и реополиглюки-на для нормализации периферического кровообращения, в значительной мере улучшает исход оперативных вмешательств, выполняемых в условиях искусственного кровообращения. Сокращению объемов трансфузии донорской крови в постперфузионном и постоперационном периодах способствовала утилизация «аппаратной» крови из АИК. Так, объем трансфузии «аппаратной» крови повысился с 0,6л в 1965—1966 гг. до 2,4 л в 1967—1968 гг. Соответственно снижению объема трансфузии цельной донорской крови в постперфузионном периоде объем операционной кровопотери уменьшился с 2,3 л в 1966 г. до 1,6 л в 1968 г., что подтверждает тесную связь массивных гемотрансфузий и повышенной кровоточивости.
Для замещения операционной кровопотери и восстановления ОЦК, кроме коллоидных кровезаменителей и «аппаратной» крови, содержащей наполовину собственную кровь больного, могут быть использованы размороженные эритроциты в сочетании с растворами альбумина, протеина, реополиглюкина или желатиноля.
Применение размороженных эритроцитов, отмытых от плазменных факторов, положительно влияет на восстановление ОЦК и нормализацию содержания в крови больного эритроцитов и гемоглобина. Это объясняется главным образом тем, что такие эритроциты, будучи донорскими, но свободными от иммуноагрессивных плазменных факторов, разведенные в реологически активных растворах, не подвергаются феномену депонирования в такой степени, как донорская кровь или донорские эритроциты, мембрана которых покрыта иммуноагрессивными плазменными факторами. В отличие от донорских эритроцитов, содержащихся в цельной крови, размороженные отмытые донорские эритроциты к концу оперативного вмешательства подвергаются депонированию в объеме 11,7% вместо 23,8% [Батукаев А. И., 1972].
Применение эритроцитной массы (размороженной или свежеприготовленной) особенно показано в тех случаях, когда у больных в исходном состоянии или в результате применения гемодилюции в постперфузионном периоде развивается значительная анемия в пределах содержания гемоглобина 80 г/л и гематокрита 0,25 л/л. Использование эритроцитной массы без разведения коллоидными растворами способствует быстрому восстановлению показателей красной крови..
Подчеркиваем, что это имеет важное значение именно тогда, когда анемия есть результат не избыточного введения растворов, которые можно вывести с помощью диуретиков (управляемая гемодилюция), а абсолютного снижения количества циркулирующего в крови гемоглобина. В этом случае диуретики не показаны. Ликвидировать истинную анемию можно лишь путем переливания эритроцитной массы, тем более размороженной и отмытой от плазменных факторов, из которых депонируется лишьУю часть.
В данной главе изложены принципиальные положения использования инфузионных средств для АИК. Возможны свои варианты перфузатов. Творческое применение современных инфузионных препаратов позволит максимально сократить объем донорской крови и тем самым способствовать профилактике посттрансфузионных осложнений.
Глава VI ТРАНСФУЗИОННАЯ ТЕРАПИЯ ПРИ НАРУШЕНИИ ПИТАНИЯ
Любая травма (ранение, переломы костей, ожоги, радиационное поражение, хирургическое вмешательство) способствует выбросу в кровь кортикостероидов и адреналина. Эти вещества нарушают гомеостаз, вызывая гипергликемию, ацидоз, гиперкоагуляцию, гипераммоние-мию, гиперкалиемию, гипонатриемию [Лабори А., 1970]. Следовательно, неизбежно наступает усиление основного обмена.
Стрессовая ситуация в большей или меньшей степени характерна как для экстренной, так и для плановой хирургической патологии. Активация основного обмена усиливает распад углеводов и белков. Этому способствуют освобожденные под влиянием кислых продуктов литические ферменты, а также утилизация белков на энергетические потребности [Рябов Г. А., 1979; KrufM., PetrasekJ, 1978].
Так возникает катаболическая направленность обмена, протекающего по Moore, в виде четырех последовательных фаз: I — фаза повреждения, или адренокортико-идная, длительностью 2—4 дня, характеризующаяся выраженным катаболизмом; II—ф а за гормонального разрешения (или точка поворота), характеризуется улучшением состояния и исчезновением гормональных сдвигов (продолжается от 3 до 7 дней); III — фаза мышечной силы с преобладанием анаболизма и положительным азотистым балансом, длительностью от 2 до 5 нед; IV — фаза накопления жира, продолжающаяся несколько месяцев.
Установлено, что запаса углеводов в условиях голода хватает на 13 ч, а белков и аминокислот — только на 4—6 ч. Следовательно, после этого периода организм пострадавшего переходит на потребление собственных белков и жиров. Так, в первые 3—5 ч шокового состояния пострадавший может потерять до 100 г тканевого белка, а при глубоких обширных ожогах на покрытие азотистых и энергетических затрат ежесуточно расходуется до 500 г мышечной ткани и 250 г жира. Потеря мышечной ткани после больших операций на органах брюшной полости составляет 300—450 г. Если учесть, что в белке содержится 16% азота, т.е. 1 г азота соответствует 6,25 г белка (а в мышечной ткани белка содержится 25%), то суточные потери азота будут составлять при шоке около 80—128 г, при ожогах — около 20 г, при операциях на брюшной полости — 12 — 18г.
Наши исследования показали, что после резекции желудка больные в первые дни теряли в среднем до 17 г азота, что соответствует 106,25 г белка, или 425 г мышечной ткани [Васильев П. С. и др., 1980]. Следует учитывать, что повышение температуры тела на 1°С увеличивает обмен на 13%.
Большие потери белка отрицательно сказываются на заживлении ран, сопротивляемости организма неблагоприятным фактором и способствуют возникновению осложнений [СуджанА. В., 1973].
При тяжелых оперативных вмешательствах потери азота настолько велики, что их не удается полностью компенсировать даже при энтеральном питании [Луком-ский Г. И. и др., 1977]. Еще более тяжело они сказываются на состоянии больных и пострадавших при вынужденном голодании (травма и операции на органах желудочно-кишечного тракта).
Р. М. Гланц и Ф. Ф. Усиков (1979) различают три периода голодания человека: 1) период усилений основного ^обмена и временного повышения энергетических затрат с наибольшими суточными потерями массы тела; 2) период неуклонного постепенного понижения основного обмена и.уменьшения суточных энергетических затрат организма, „дюгда происходят мобилизация жира из жировых депо и 'Транспортировка его в печень, где он и окисляется; 3) период ^возрастания распада резервного белка, когда происходит ^неэкономное расходование пластического белка, в том числе Уу. жизненно важных органов.
|; Практически с 1-го дня голодания как для пластических Уцелей, так и для энергетического обеспечения организм ^человека утилизирует структурный белок мышц, органов, ^ферменты и гормоны. Это приводит к нарушению регуляции ^обмена веществ. Уже в 1-е сутки резко снижается синтез |альбумина в печени и других органах, что ведет к понижению [КОД и водоудерживающей функции плазмы крови. Развивается белково-волемические нарушения [Лукомский Г. И. и др., 1976]. При полном или частичном белковом голодании печень может потерять до 40% белков. В то же время в ней [ накапливается жир, ухудшая ее функциональное состояние. : В связи с белковой недостаточностью и утилизацией ' ферментов наступает дискоординация деятельности ферментных систем [Кошелев Н. Ф., 1975]. Быстро уменьшается; активность ферментных систем, осуществляющих переами-нирование, дезаминирование и синтез аминокислот. В пече- [ ни снижается синтез мочевины, в связи с чем количество ее I почти вдвое уменьшается. Одновременно увеличивается количество аминокислот и значительно меняется аминокислотный спектр сыворотки крови [Климан-ский В. А. и др., 1979]. Понижается интенсивность окислительных процессов, в связи с чем происходит неполная утилизация распадающихся белков и жиров, изменяется кислотно-щелочное состояние. Нарушается координация | других видов обмена веществ, развиваются морфологиче-1 ские изменения в виде атрофии слизистой оболочки тонкой кишки почти до полного исчезновения ворсинок с нарушением всасывания углеводов и жиров, что приводит к появлению поноса. Продолжительная белковая недостаточность ведет к морфологическим, биохимическим и функциональным нарушениям регуляции желез внутренней секреции и других специфических функций.
Из сказанного ясно, какое важное значение в лечении больного имеет питание. Бесспорно, самым лучшим является энтеральное питание, но, как мы уже отмечали, при тяжелых стрессовых ситуациях оно недостаточно. В таком случае возникает необходимость в парентеральном питании (ПП).
Задача и цели ПП вытекают из описанного выше патогенеза голодающего организма человека, а также из патогенеза стрессовой ситуации, в которой оказался пострадавший или больной, перенесший хирургическое вмешательство. Они сводятся к применению средств ПП для пластических целей, энергетического обеспечения и стимуляции их усвоения. В более широком понимании в задачи ПП входят заместительное питание или введение цельных белков (альбумин, протеин, нативная плазма, концентрат нативной плазмы) в сосудистое русло при гипопротеинемии и устранение белково-волемических расстройств.
До недавнего времени при вынужденном голодании и необходимости вспомогательного ПП клиницисты ограничивались введением углеводов (глюкоза, реже этиловый спирт) и некоторых электролитов (натрий, калий, хлор). Достижения современной биохимии и физиологии питания вооружили клиницистов белковыми препаратами, средствами энергетического обеспечения, обосновали необходимость введения электролитов, микроэлементов, витаминов и стимуляторов усвоения средств ПП. Все это позволило изучить проблему ПП на научной основе и в то же время существенно усложнило задачи клинициста, оказывающего непосредственную помощь больному.
Краткая характеристика препаратов ПП. Основными компонентами питания являются белки, углеводы и жиры;
необходимы также электролиты, микроэлементы, витамины и стимуляторы усвоения средств питания. Ведущее место в ПП занимают белковые препараты, которые являются источниками азота. Активное внутривенное белковое питание может быть осуществлено с помощью белковых гидролизатов и сбалансированных аминокислотных смесей. С заместительной целью (восполнение цельных белков в сосудистом русле) применяются альбумин, протеин, плазма.
Препараты азотистого питания должны содержать 8 незаменимых аминокислот: изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан, валин.
Отечественная промышленность выпускает три препарата гидролизатов белка.
Гидролизат казеина, разработанный в Центральном ордена Ленина институте переливания крови ^(ЦОЛИПК) и получаемый в результате кислотного гидролиза казеина, содержит 0,70—0,95% общего азота, 35—45% которого приходится на азот аминокислот. В составе его
•имеются все незаменимые аминокислоты. Кроме того, к ^препарату добавлены 0,55% хлорида натрия, 0,04% хлорида; калия, 0,05% хлорида кальция и 0,0005% хлорида магния. t Гидролизин Л-103 получен кислотным гидроли-^зом белков крови крупного рогатого скота. Содержание ^общего и аминного азота в нем, как и во всех отечественных 1гидролизатах, примерно одинаково. К препарату добавлены ^2% глюкозы, 0,8 — 0,9% хлорида натрия и 0,02% хлорида ""кальция. Лимитирующей аминокислотой в нем является | изолейцин.
f Аминопептид — препарат, получаемый методом ^ферментативного гидролиза, не отличающийся принципи-^ально по составу от предыдущих гидролизатов. Лимитиру-^ющей аминокислотой в нем также является изолейцин. I Учреждениями службы крови и лабораториями выпуска-Нются аминокровин и другие гидролизаты. Кроме |того, начат промышленный выпуск усовершенствованных t гидролизата казеина и гидролизина. За рубежом также j производятся гидролизаты белка: аминозол (Швеция),
* минон (Финляндия), амиген (США), изовак (Франция), i..миноплазмаль (ФРГ), альвезин (ГДР) и др.
В отделе парентерального питания ЦНИИГПК под руководством проф. П. С. Васильева разработан и апробирован в ряде ведущих клиник страны новый отечественный j аминокислотный препарат полиамин. Он представляет | собой 8% раствор смеси 13 чистых аминокислот (в их числе все незаменимые) с добавлением 50 г сорбита с содержанием азота 11,3 г/л.
Из зарубежных аминокислотных смесей широко применяются мориамин S-2, по питательной ценности близкий к полиамину, и ряд других препаратов.
Анаболический эффект препаратов белкового ПП в значительной мере зависит от обеспечения организма небелковыми энергетическими веществами. Введение источников энергии одновременно с пластическими азотистыми веществами в условиях голодания при нарушении окислительно-восстановительных и других метаболических процессов предупреждает утилизацию собственных белков организма и вводимых аминокислот по пути глюконеогене-за, т.е. «сгорания» для энергетического обеспечения. Следовательно, средства энергетического обеспечения лают азотсберегающий эффект, причем углеводы — больший, с;
жировые эмульсии — несколько меньший. К источникам энергетического обеспечения относятся углеводы, спирты г, жировые эмульсии.
Углеводы. В клинической практике применяют моносахариды (глюкоза, фруктоза). По эффективности и влиянию на организм человека наиболее распространенным препаратом остается глюкоза, применяемая для ПП в ви де 5; 10; 20; 30; 40 и 70% растворов с соответствующим количеством инсулина (1 ЕД на 3—5 г сухого вещества глюкозы).
С п и р т ы. К применяемым при ПП спиртам относятся этанол, полиолы (сорбит и ксилит), диолы (1,2-пропандиол и 1,3-бутандиол). Однако они не используются из-за худшем по сравнению с моносахаридами усвояемости, побочного токсического действия (этанол), малой изученности (диолы).
Жировые эмульсии. Высокая калорийность жира (1 г — 9 ккал) позволяет в небольшом объеме жидкости вводить значительное количество калорий. Преимущество жировых эмульсий состоит и в том, что их можно вводить в любые, в том числе периферические, вены. Наряду с азотсберегающим эффектом жировые эмульсии необходимы организму человека для синтеза фосфолипидов играющих важную роль в белковом и липидном обмене.
Практическое применение в ПП получили 10—20^' жировая эмульсия интралипид (Швеция) и липофундиь (Финляндия). Ведутся работы по получению отечественных жировых эмульсий.
Минеральные в е щ е с т в а и микроэлементы. Наряду с белками, углеводами и жирами при ПП большое значение имеют минеральные вещества: калий, натрий, кальций, фосфор, железо, магний, хлор и сера. К микроэлементам относят марганец, цинк, кобальт, молибден, йод, фтор, никель и др.
Минеральные вещества принимают участие в важнейших метаболических и физиологических процессах (реакции энергетического обмена, мышечного сокращения, окислительно-восстановительные процессы), входят в структуру клеток, в том числе крови, и мембран, участвуют в осмотических* процессах и т.п. Микроэлементы находятся в ферментных системах, гормонах и т.д.
Если ПП назначают на короткий срок (3—7 сут), в его состав целесообразно включать препараты калия, натрия, кальция, магния, хлора, фосфора и цинка. Последний содержится в ряде ферментов и способствует ускорению заживления ран. При длительном ПП целесообразно использовать все перечисленные электролиты и микроэлементы.
Витамины. Известно, что водорастворимые витамины (группы В, С и др.) участвуют в построении различных коферментов, а жирорастворимые витамины (A, D, Е, К) — в контроле функционального состояния мембран и субклеточных структур. Отсюда ясна их роль в переаминировании, декарбоксилировании и других процессах, активирующих белковый и углеводный обмен. Особенно важно применение витаминов при ПП больных с явлениями белковой недостаточности, когда выражен их большой дефицит, а метаболизм вводимых веществ требует активации анаболических процессов за счет ферментов, в состав которых входят витамины группы В, и усиления окислительно-восстановительных процессов с участием аскорбиновой кислоты.
Стимуляторы эффективности ПП. Для усиления эффекта ПП, кроме витаминов, применяются анаболические гормоны (неробол, ретаболил), андрогены, гормон роста, инсулин, некоторые пиримидиновые производные (пентоксил, метилурацил). Анаболические стерои-ды, как и андрогены, стимулируют молекулярные механизмы биосинтеза белка. Механизм действия анаболических стероидов направлен на увеличение синтеза белка из аминокислот с уменьшением их выхода в мочевину и на снижение катаболизма. Аналогично влияют и андрогены. Последние увеличивают активность ферментов в белковом обмене. Все это способствует задержке азота и накоплению белка в мышцах, усилению роста и прибавке массы тела, благоприятно влияет на репаративные процессы.
Инсулин содействует сохранению и накоплению энергетических и пластических материалов в клетке, повышая синтез основных составных ее частей — белков, гликогена и жиров. Он стимулирует синтез ключевых ферментов гликолиза, создавая тем самым предпосылки для энергетического обеспечения синтеза белка. Одновременно индуцируется образование гликогенсинтетазы, усиливающей продукцию гликогена, тормозится липолиз и стимулируется липогенез. Инсулин является сильным супрессором транса-миназ, что исключает участие аминокислот в энергетических процессах и создает возможность максимально использовать гх для биосинтеза белка.
Используемая при ПП глюкоза сама является возбудителем секреции инсулина. Существует определенный параллелизм между интенсивностью поступления глюкозы и ответной реакцией лангергансовых островков. Секрецию инсулина индуцируют и некоторые аминокислоты (аргинин, лейцин). Наличие такой связи между концентрацией глюкозы в крови и секрецией инсулина делает ненужным дополнительное введение его. Однако при стрессовых ситуациях этот механизм может нарушаться. Такие состояния сопровождаются значительным выбросом катехоламинов и резким снижением толерантности к глюкозе. В этих условиях, а также при использовании концентрированных растворов глюкозы показано введение инсулина.
Пиримидиновые производные усиливают репаративные процессы в ране, повышают антитоксическую и белоксинте-зирующую функцию печени и ограничивают катаболическую реакцию, усиливая анаболический эффект ПП.
Важную роль в усвоении средств ПП играют макро- и микроциркуляция, полноценный транспорт компонентов по сосудистому руслу и через клеточные мембраны. В этом отношении большое значение придается поддержанию объема циркулирующего альбумина.
Показания. В настоящее время показания к ПП весьма многообразны. Коротко их можно сформулировать так:
ПП применяют, если больной не может, не должен или не хочет питаться через рот.
Перечень патологических состояний, при которых используют ПП, достаточно велик. Это травмы и операции на желудочно-кишечном тракте, черепно-мозговая травма, ожоги. Хорошие результаты ПП дает при перитонитах, панкреатите, энтероколите и других заболеваниях органов брюшной полости. К ПП прибегают при некоторых психических заболеваниях. Другими словами, в тех случаях когда невозможен энтеральный путь подведения питательных веществ, можно и должно применять ПП.
Для успешного ПП важно иметь представление о суточной потребности (табл. 10). При этом необходимо соблюдать следующие условия: 1) предварительно устранить гемодинамические расстройства и восполнить внутри-сосудистый дефицит глобулярного и, главное, плазменного объема', 2) ликвидировать грубые расстройства водно-солевого обмена и кислотно-щелочного состояния; 3) восстановить функции жизненно важных органов и систем (дыхание, сердечная деятельность).
ПП может быть полным, когда в ор анизм пострадавшего или больного вводят все питате тъные вещества, неполным, когда используют только основ-
Таблица 10. Суточная потребность в калориях и белке при ряде патологических состояний [Герасимова Л. И., 1974]
| С ист on mir больно! о | OdiOBHO | 1 обмен | Потребность в fit-JIKf (J/CVT) больного f M.iccoil ir.iii 70 кг |
| % нормы | KK.l.'l /CVT | ||
| Норма | 1 800 | ||
| Температура тела °С 38 | |||
| 2 150 | |||
| Послеоперационный период: | |||
| операции в верхней половине брюшной полости тяжелые операции | 115 130 | 2 100 2350 | 110 140 |
| Постравматические состоя | |||
| ния: | |||
| тяжелые ожоги | |||
| сотрясение мозга ушиб мозга | 185 300 | 3300 5400 | |
| столбняк |
ные питательные вещества (белки или белки и углеводы, или белки, углеводы и жиры), и вспомогательным, когда питание через рот недостаточно и его нужно дополнить отдельными веществами (белки, белки и углеводы в неполной дозировке).
Расчет потребности в средствах ПП и методика его ведения. Наиболее важное значение имеет азотистый, т.е. белковый компонент, поэтому расчеты начинают с определения индивидуальной потребности в азотистых веществах. Эта потребность зависит от величины эндогенного катаболизма (НЭ), т. е количества азота мочи, выделившегося при безазотистой диете, и степени использования азота вводимого препарата, определяемой по формуле Митчелла:
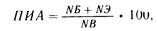
где ПИЛ — показатель использования азота, или показатель усвоения азота, или показатель истинного использования белка, %; НЭ — эндогенный катаболизм; НБ азотистый баланс, или разность введенного и выведенного азота за сутки; НВ — азот, выведенный за сутки.
К более простым методам относится расчет, при котором исходят из средней суточной потребности больного и здорового человека. Установлено, что в течение суток здоровый взрослый человек нуждается в среднем в 0,7—1;
условного белка на 1 кг массы тела, дети — 2,5 г на 1 ю массы тела. Потребность больных при легких и средне ii тяжести операциях соответствует потребности здорового человека. При более тяжелых операциях она увеличивается до 1,5—2 г на 1 кг массы тела.
Зная эти данные и содержание азота в препарате. нетрудно вычислить потребность больного в количестве препарата. Например, взрослому человеку с массой тело 70 кг, имеющему повреждение органов брюшной полости вследствие травмы или операции, при суточной потребности 1,5 г условного белка на 1 кг массы тела требуется 1,5х70=105 г белка. Если предполагается инфузия полиамина (1,13 г азота в 100мл), то, умножив 1,13 г на 6,25 (коэффициент пересчета азота в белок), получим 7,125 г условного белка в 1W мл. Тогда количество полиамина составит
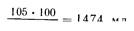
7,125 ' " ' "'"""
Аналогично производится расчет гидролизата казеина с примерным содержанием общего азота 0,8 г в 100 мл, что соответствует 5 г условного белка:
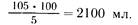
Известен расчет по количеству мочевины. Учитывая, что в среднем 80% общего азота мочи составляет азот мочевины, можно подсчитать потерю азота с мочой (через почки выделяется 85%, с потом и через кишечник — 15% всего азота). Известно, что 1 г мочевины содержит 0,466 г азота. Зная суточное количество мочевины в моче, можно вычислить потерю азота: количество мочевины мочи в сутки, умноженное на 0,466, равно количеству азота мочевины. Например, больной выделил за сутки 30 г мочевины, тогда 30 • 0,466= 14 г азота, но это только 80% общего азота мочи, а 100% будет составлять (14 • 100):80=17,5 азота. В переводе на условный белок это составит 17,5 • 6,25 =109,4 г. С учетом приведенных выше расчетов полиамина потребуется (109,4 • 100):7,125= 1530 мл, а гидролизата казеина — соответственно 2183 мл.
Следует отметить, что в гидролизатах для пластических целей быстро утилизуется только азот аминокислот, т.е. 45—50% от общего азота препарата, что значительно снижает эффективность ПП гидролизатами по сравнению с аминокислотными смесями. Так, расчеты показывают, что в 100 мл гидролизата казеина содержание условного белка из аминокислот 2,5 г, в полиамине — выше 7 г, что почти в 3 раза больше. Следовательно, для пластических целей полиамина надо вводить почти в 3 раза меньше.
Таким образом, для расчетов нужно знать количество азота или условного белка в препарате. Хотя последние два метода не отличаются идеальной точностью и, кроме массы тела, не отражают других индивидуальных особенностей больного, которые могут повлиять на потребности в препарате, в практике ПП их легче использовать для расчета, можно применять в любом лечебном учреждении.
Основываясь на формуле Митчелла, Р. М. Гланц и ф. Ф. Усиков (1973, 1979) предложили формулу для определения количества трансфуз ионной азотистой среды:
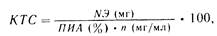
где К ТС — количество трансфузионной среды, мл; п — содержание азота, мг в 1 мл препарата.
Поскольку определение эндогенного азота практически очень сложно, авторы разработали метод определения эндогенного катаболизма с учетом величины основного обмена.
N3--Q ' К,
где О — величина основного обмена больного в килокалориях; А' — коэффициент пересчета основного обмена в эндогенный катаболизм; НЭ — эндогенный катаболизм (азота), мг.
Коэффициенты пересчета получены авторами для конкретных трансфуз ионных программ (гидролизат-+-витамины + инсулин; гидролизат -+- витамины + инсулин 4- анабо-лический стероид), что ограничивает их применение при использовании других сред парентерального питания.
Максимальное и целенаправленное усвоение азотистых веществ возможно при условии достаточного энергетического обеспечения. Потребность здорового человека в энергетических веществах составляет в среднем 25—30 ккал на 1 кг массы тела в сутки, пострадавших и больных после операции — 35—40 ккал и более. Так, больному с массой тела 70кг нужно ввести 70х40=2800 ккал в сутки. Зная калорийность препарата и потребность в калориях, нетрудно рассчитать количество сухого вещества и выбрать концентрацию его раствора, которая оказалась бы применимой по действию на организм больного и по количеству вводимое, жидкости.
Другой способ расчета потребности в энергетические веществах заключается в использовании отношения калории к количеству потребляемого азота в граммах. Оно должш составлять 150—200:1. Тогда в приведенном примере больному с массой тела 70 кг и потребностью в 1,5 г услов ного белка на 1 кг нужно ввести 105 г белка, что соответствует 16,8 г азота. Следовательно, соотношение калорий и азота 2800:16,8=170 ккал на 1 г азота, что соответствует допустимым пределам.
Мы уже отмечали, что в настоящее время наилучшие средством энергетического обеспечения признана глюкоза Это объясняется большой потребностью в ней тканей и хорошей усвояемостью (минимальная суточная потребность около 180 г; при травмах и регенеративных процессах она может возрастать вдвое). Глюкоза является исходные компонентом синтеза РНК и способствует интенсивному включению аминокислот в тканевые белки.
Введение глюкозы со скоростью выше 0,5г/кгхч повышает ее содержание в крови до 8,2—9,9 ммоль/л, что является почечным порогом, выше которого наступает глюкозурия и осмотический диурез. Кроме того, в 1—2-й день послеоперационного периода и при других стрессах в адренокортикоидной фазе катаболизма нарушается усвоение глюкозы и уменьшается чувствительность ее к инсулину. В эти дни даже при введении 0,25 г на 1 кг массы тела в час может возникнуть глюкозурия. Нередко комбинируют глюкозу с фруктозой, спиртами (этанолом, полиолы). В виде гипертонических растворов (10; 20; 30; 50 и 70%) ее применяют при введении только в центральные вены во избежание возникновения флебитов.
Наши исследования показали, что введение 30% раствора глюкозы с инсулином не вызывает осложнений. У ряда пожилых больных в адренокортикоидной фазе при превышении почечного порога и возникновении глюкозурии мы в первые 2 дня после операционного периода концентрацию глюкозы снижали до 10—20%.
Общее количество глюкозы, вводимое разными исследователями, составляет от 100 до 750 г сухого вещества. количество глюкозы, обеспечивающее менее. 20% общей калорийности (около 100 г сухого вещества), вводить нельзя, так как наступает усиление катаболизма, изменения метаболизма азотистых веществ в направлении глюконеогенеза и может возникнуть кетоз. Оптимальным является покрытие
г-; 50% энергетического обеспечения за счет глюкозы. При
Применении Д0% раствора глюкозы эта величина составляет.1—1,5л.
Кроме глюкозы, применяют жировые эмульсии; они не вызывают полиурии, 'не наступает их потеря с мочой и калом. Временная гиперлипемия, возникающая после введения эмульсии, быстро исчезает. Необходимость введения жировых эмульсий, их азотсберегающий эффект, участие в стимуляции обменных процессов в настоящее время доказаны. Липиды являются составными частями клетки, входят в состав биологических мембран, поэтому потеря их при ^голодании отрицательно сказывается на обменных про-• цессах.
Необходимо энергетическое обеспечение жировыми эмульсиями от 30 до 40% общей калорийности, что достигается применением 10—20% жировых эмульсий в объеме 0,5—1 л.
Известно, что соотношение основных компонентов питания (белки, углеводы, жиры) у здоровых людей колеблется в различных территориальных регионах. Наиболее распространено следующее распределение по калорийности: белки— 10—15%, углеводы— около 50%, жиры— 35—40% общей калорийности. Примерно те же соотношения целесообразны при ПП.
Составление программы ПП можно показать на примере трансфузионной терапии после резекции желудка. Белковый компонент ПП назначается по 1 г условного белка на 1 кг массы тела. Больному с массой тела 70 кг полиамина, содержащего, как мы рассчитали выше, 7,125 г условного белка в 100 мл, потребляется:
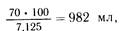
т.е. около 1 л. Однако 1 л полиамина содержит 11,3 г азота.Умножив 11,3 на 200 (отношение азота к количеству небелковых калорий), получим 2260 ккал, из которых 50% должны составлять углеводы (глюкоза), от 10 до 15% — белки и от 35 до 40% — жировые эмульсии. Следовательно, глюкоза должна обеспечить 2260:2= 1130 ккал. Известно, что 1 г глюкозы— это 4,1 ккал. Разделив 1130 на 4,1, получим количество сухого вещества глюкозы — 275,6 г. Если применить 30% раствор, то объем глюкозы будет оавен:
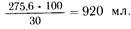
В 1 л полиамина условного белка содержится 11,3 х 6,25 =70,6 г, что составит 70,6х5,3 =374 ккал (5,3 ккал содержит 1 г белка), а 374 ккал по отношению к 2260 составляют 12,1%. Следовательно, на долю жировых эмульсий остается 50—12,1 =37,9%, т. е.
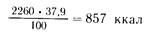
1 г жира обеспечивает 9 ккал, поэтому чистого жира потребуется 857:9=95 г. Следовательно, 10% жировой эмульсии необходимо 950 мл, т.е. около 1 л, а 20% — 500 мл.
Остается рассчитать общее количество жидкости:
полиамина 1 л, 30% раствора глюкозы 920 мл и 10 % жировой эмульсии 1 л, всего 2 л 920 мл, что является оптимальным количеством. Для непродолжительного ПП (3 сут) можно ограничиться предложенной программой неполного ПП.
Кроме указанных расчетов, проводятся расчеты на основе массы и площади поверхности тела (табл. 11).
Таблица 11. Суточные дозы и оптимальная скорость введения некоторых препаратов ПП [Глущенко Э. В., 1974]
| Суточн | ая доча | Оптималы | ая скорость | |
| введения | ||||
| На.жание препарат;] | ||||
| [ 11,4 1 КГ | i на 1 м'' | Г/ (КГ • Ч) | г/(м2 • ч) | |
| массы теча | поверхности | |||
| тела | ||||
| Глюкоза Фруктоза | 2-6 | 100—300 40 | 0.5 0.4 | 20 17 |
| Спирт этиловый | 0,1 | |||
| Белок (условный) Аминокислоты Общий азот Жиры | 1-2 0,16 0-1,5 | 40—80 30 7 70 | 0,1 0,15 0,02 0,2 | 4 6 0 8 |
Кроме перечисленных компонентов, для полного ПП необходимы минеральные вещества, витамины и стимуляторы эффективности ПП.
Учитывая, что водно-электролитный баланс подробно описан в литературе по хирургии, мы ограничимся приведением потребностей в указанных средствах и прописи препаратов (табл. 12, 13).
Многие исследователи не без основания считают, что в подключичную вену, куда вводятся компоненты ПП, нецелесообразно вводить другие лекарственные средства.
Таблица 12. Потребность в компонентах полного ПП больных и пострадавших [Schenkin A., Wretlind A., 1978]
| Потребность на | 1 кг массы тела взрослого человека в сутки | |
| Компоненты ПП ————————————г-д.ти здоровых | для больных в со- | для тяжело боль |
| и больных в со | ных и пострадав | |
| стоянии умеренной | 'тяжести и постра | ших |
| тяжести | давших | |
| Вода, мл 30 | 100-150 | |
| Энергетическое обеспечение, ккал 30 | 35—40 | 50—60 |
| Азот аминокислот, мг 90 | Г) 9 Л Ч U,^——V.J | 0 л п ^ U.^t——u,l> |
| 1 люкоза, г 2. | ||
| w ч п г о /1\ир, г z | ч <J | Ч 4 о— ^ |
| Натрий, ммоль 1—1,4 | 9 3 ^ <J | 3—4 |
| Калий, ммоль 0,7—0,9 | Ч 4 J—— Ч | |
| Кальций, ммоль 0,11 | 0,15 | 0,2 |
| Магний, ммоль 0,04 | П i к п 90 U, 1 0 ——u.ZU | п ч (\ л U,0——V,' |
| Железо, мкмоль 0,25—1,0 | ||
| ЛЛарганец, мкмоль 0,1 | Г) Ч u,o | 0,6 |
| Цинк, мкмоль 0,7 | 0,7—1,5 | 1,5—3,0 |
| Медь, мкмоль 0,07 | 0,3—0,4 | 0,4—1,0 |
| Хром, мкмоль 0,015 | ||
| Селен, мкмоль 0,006 | ||
| Молибден, мкмоль 0,003 | ||
| Хлор, ммоль 1,3—1,9 | 9 Ч L ——0 | |
| Фосфор, ммоль 0,15 | 0,4 | 0,6—1,0 |
| Фтор, мкмоль 0,7 | 0,7—1,5 | |
| Йод, мкмоль 0,015 | — |
Введение средств ПП надо начинать с 30% раствора глюкозы, к которому добавлен инсулин из расчета 1 ЕД на 5 г сухого вещества глюкозы. Если содержание сахара в крови превышает «почечный порог» (99 ммоль/л) и наблюдается глюкозурия, то дозу инсулина увеличивают до 1 ЕД на 4 г или даже на 3 г сухого вещества глюкозы. После введения 200—300 мл раствора глюкозы в одноразовую систему через прокол резиновой трубки перед канюлей, соединяющей систему с подключичным катетером, начинают вводить аминокислотный препарат или гидролизат. В дальнейшем аминокислотную смесь или гидролизат вводят вместе с глюкозой. К раствору глюкозы добавляют электролиты и витамины.
Таблица 13. Потребность в витаминах при полном ПП больных и пострадавших [Schenkin A., Wretlind A., 1978]
| Витамины —————————————г для:<дировы\ и больных в состоянии умеренной | для больных в состоянии сред- | )c.'iuro человека для тяжелобольных |
| Тиамин, мг 0,02 Рибофлавин, мг 0,03 Никотянамид, мг 0,2 | 0,04 0,06 0,4 | 0,3 0,3 2 |
| Пиридоксин, мг 0,03 Фолиевая кислота, мкг 3 | 0,06 | 0,4 |
| Цианкобаламин, мкг 0,03 Пантотеновая кисло | 6 0,06 | 6—9 0,06 |
| та, мг 0,2 Биотин, мкг 5 | 0,4 | 0,4 |
| Аскорбиновая кисло | ||
| та, мг 0,5 Ретинол, мкг 10 Эргокальциферол, мкг 0,04 | 2 10 0,04 | 25 20 0,1 |
Скорость введения аминокислотных смесей и гидролиза-тов находится в обратной зависимости от усвоения препарата, т.е. чем выше скорость, тем меньше его усвояемость. Аминокислотные смеси и гидролизаты целесообразно вводить со скоростью не больше 40 капель в минуту. Скорость введения глюкозы — 0,5 г сухого вещества на 1 кг массы тела в час. Практически больному с массой тела 70 кг 30% раствор глюкозы можно вводить со скоростью 40 капель в минуту.
Жировые эмульсии вводят вместе с аминокислотными смесями или гидролизатами. Их нельзя вводить вместе с электролитами, так как последние способствуют укрупнению жировых частиц, что создает опасность жировой эмболии. Если азотистый препарат содержит много электролитов, то жировые эмульсии надо вводить отдельно. В 1-й день следует вводить половину или четвертую часть дозы жировой эмульсии для проверки на реактогенность, а начиная со 2-го дня — всю суточную дозу. Вначале скорость вливания должна быть 10 капель в минуту. Через полчаса ее можно увеличить до 15 капель в минуту. При этой скорости меньше опасность аллергических, пирогенных и токсических реакций. При отсутствии реакции скорость можно увеличить до 20—30 капель в минуту. На каждые 500 мл жировой эмульсии вводят 5000 ЕД гепарина.
Для стимуляции эффекта ПП, кроме витаминов и инсулина, надо применять анаболические стероиды (5% раствор ретаболила по 2 мл внутримышечно 1 раз в 3—5 дней).
На примере приведенного выше расчета для больного с массой тела 70 кг, перенесшего резекцию желудка, составим график введения препаратов с указанием их прописей (табл. 14). При введении препаратов ПП необходимо постоянно следить за капельницей, так как при неравномерном уменьшении количества препарата во флаконах (особенно /это касается препаратов, которые вводят с различной скоростью, например полиамина и интралипида) число капель в минуту меняется.
Методы контроля эффективности ПП. Такие методы многочисленны и все еще трудоемки. Их можно разделить на клинические и лабораторные. К первым относятся: 1) определенные массы тела (взвешивание); 2) исследование гемо-динамики (частота сердечных сокращений, артериальное и центральное венозное давление); 3) определение почасового диуреза; 4) оценка общего состояния больного в процессе ПП.
Лабораторная диагностика предусматривает определение следующих показателей: 1) коллоидно-осмотического давления (ежедневно); 2) гематокрита (ежедневно); 3) инкремента мочевины ежедневно (разница мочевины крови до и через 40 минут после введения; чем меньше разница, тем выше анаболическая эффективность белкового препарата);
4) гемоглобина (1 раз в 2—3 дня); 5) ОЦК и его компонентов (1 раз в 2—3 дня); 6) кислотно-щелочного состояния (ежедневно); 7) мочевины мочи (суточное количество) ежедневно.
Для контроля за функциональным состоянием органов и систем необходимы также определение содержания билиру-бина, трансаминаз, состояния свертывающей системы и другие общепринятые лабораторные исследования.
Большинство перечисленных методов контроля можно применять в хорошо оснащенных стационарах.
Для оценки возможной гипергидратации или дегидратации можно использовать следующую формулу:
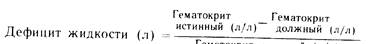
Масса тела (кг)
X ———————————
Если полученный результат будет со знаком минус, то во внеклеточном пространстве имеется недостаток жидкости (дегидратация), если со знаком плюс, то избыток ее (гипергидратация).
При введении препаратов ПП возможны аллергические, пирогенные и токсические реакции.
Первые два вида реакций связаны с сенсибилизацией больных и скоростью переливания. Чем меньше скорость вливания препаратов, тем меньше реакций. Аллергические реакции клинически протекают в виде кожного зуда, сыпи, отека век и лица, удушья, цианоза, болей в пояснице. Повышение температуры часто сочетается с аллергическими реакциями и может возникать при многократном использовании систем для переливания жидкостей.
Токсические реакции возникают преимущественно в ответ на введение инфицированных препаратов, что возможно при нарушении герметичности, неправильном хранении (на свету, в жарком помещении) или нарушении технологии приготовления, и клинически проявляются анафилактическим шоком с последующей острой почечной и почечно-печеночной недостаточностью.
Таблица 14. График введения компонентов ПП больному с мае
| К(,шюн,.нт ПП | OC)ii[('c' ы1 | 1—————- | ^-————,——-—————- | ||||||||
| личгстно | ВВС''1УНГЯ | гм,.т.,.1; то | ^,-П.ПДТО,. | ||||||||
| ;ipt"[i;ipiiTri | И МИ!!\ Г, | 1 ч | 2ч | ,,ч | .1 ч | 5.1 | 6 ч | 7" | S " | Оч | |
| Полнымин | 1 Л | 40 кч ^\f п<-1 " 1 | |||||||||
| пел ь в | |||||||||||
| 30% раствор глю | минуту | - | - | - | - | ||||||
| козы 4-55 ЕД ин | |||||||||||
| сулина 20% ингралипид | 920 мл 500 мл | 40» » -20»»» | - |
! I [) и i\! e ч а и и е. Дополнительно к указанным в таблице растворам
Профилактика реакций при слабовыраженных аллергических и пирогенных проявлениях состоит в уменьшении скорости или прекращении вливания, введении наркотиков и антигистаминных препаратов. Через 15—30 мин введение препарата можно продолжить. Однако при появлении повторных реакций препарат данной серии вливать нельзя. При тяжелых реакциях вливание прекращают, а препарат направляют на лабораторное исследование.
Описанные реакции возникают преимущественно при введении азотистых препаратов, пирогенные — часто при применении жировых эмульсий.
При избыточном введении глюкозы возможны глюкозу-рия, осмотический диурез, гиперосмолярность и гиперглике-мическая кома, а при передозировке инсулина — и гипогли-кемическая кома. При введении высоких концентраций глюкозы могут наблюдаться ее карамелизация в сосудистом русле и гиперфосфатемия. Мерами профилактики являются уменьшение скорости введения и контроль содержания сахара крови (до 4 раз в сутки).
Из других осложнений, связанных с препаратами ПП, следует назвать ацидоз и жировую эмболию у больных с шоковым легким. Возможны такие осложнения, связанные с избытком или недостатком электролитов (гипер- и гипока-лиемия).
Серьезную опасность представляют септические осложнения, связанные с катетеризацией вен, флебиты, тромбофлебиты, сепсис, эмболии. Профилактика этих ослож-
Сой тела 70 кг после резекции желудка без осложнений
| (мл) п ~:: | P,i,.IH,n„K. 1, | U.M4 |
|
Дата добавления: 2014-01-04; Просмотров: 490; Нарушение авторских прав?; Мы поможем в написании вашей работы!
Генерация страницы за: 0.016 сек.