
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Образование растворов, растворимость
НЕКОТОРЫЕ РАВНОВЕСИЯ В РАСТВОРАХ
Растворами называют системы, в которых одно или несколько веществ распределено в среде одного или нескольких веществ. Раствор представляет собой однофазную систему, состав которой в некотором интервале концентраций, температур и давлений может меняться непрерывно. Состояние растворов относится к любому агрегатному состоянию – твердые растворы, например, сплавы металлов; жидкие – наиболее многочисленная группа; газовые, например, воздух. Идеально чистых веществ не может быть, поэтому и индивидуальные вещества могут быть отнесены к растворам.
Процесс образования растворов – самопроизвольный, поэтому энергия Гиббса растворения отрицательна. Это возможно при эндотермическом растворении лишь в случае положительного значения энтропии растворения, при этом также должно выполняться TDS > DH. При экзотермическом растворении наиболее благоприятен случай с положительной энтропией растворения. При экзотермическом растворении самопроизвольно пойдут и процессы растворения с отрицательной энтропией при выполнении условия |TDS| < |DH|.
При образовании растворов ситуация с DSраств > О широко распространена, так как происходит распределение частиц растворяемого вещества в большом количестве растворителя, что ведет к резкому росту неупорядоченности в системе.
При росте концентрации происходит дальнейшее растворение растворяемого вещества. Растворы, в которых возможно дальнейшее самопроизвольное растворение, называются ненасыщенными. Наконец, при дальнейшем растворении достигается концентрация, при которой энергия Гиббса растворения достигает минимума. Полученный раствор вобрал в себя максимум при данных условиях растворенного вещества, он называется насыщенным раствором. Насыщенный раствор термодинамически устойчив и находится в равновесии с растворяемым веществом. Значение концентрации насыщенного раствора называется растворимостью.
Значение растворимости может быть найдено по термодинамическим данным. Например, требуется найти концентрацию (активность) насыщенного раствора вещества А в данном растворителе. Для равновесия

константа равновесия имеет вид:
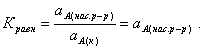 (3.1)
(3.1)
С другой стороны, для указанного процесса:
ΔGo = ΔGoобрA(р-р, ст.с) – ΔGoобрA(к) = –RTlnKравн = –RTlnA(нас.р-р). (3.2)
Можно получить и растворы, концентрация растворенного вещества в которых превышает концентрацию насыщенного раствора. Это – пересыщенные растворы. Поскольку растворение вещества в насыщенном растворе невозможно (ведет к положительному значению энергии Гиббса), получить пересыщенный раствор растворением вещества в насыщенном растворе нельзя. Обычно пересыщенные растворы получают, охлаждая насыщенные при более высокой (другой) температуре растворы. При этом энергия Гиббса уменьшится, но не настолько, чтобы раствор оставался равновесным. Пересыщенные растворы – это системы в кажущемся равновесии.
Понятия растворитель, растворенное вещество, концентрированный или разбавленный раствор условны. Так концентрированным водным раствором будут считаться 6 мас.% раствор КМnО4, 98 мас.% раствор Н2SO4, 35 мас.% раствор NаCl.
Основными способами выражения концентраций растворов являются: массовая, мольная, объемная (для газовых растворов) доля растворенного вещества или растворителя и соответственно массовый, мольный или объемный процент: молярность, нормальность, титр и моляльность.
Массовая доля компонента раствора ω равна отношению массы этого компонента к массе раствора, то есть к сумме масс всех компонентов раствора, включая растворитель.
Мольная доля компонента раствора равна отношению числа молей этого компонента к сумме числа молей всех компонентов раствора. Аналогично, для газовых растворов объемная доля компонента равна отношению объема этого компонента к сумме объемов всех компонентов газовой смеси.
Массовая (мольная, объемная) доля компонента, умноженная на 100, называется массовым (мольным, объемным) процентом.
Молярность М раствора определяется как число молей (количество вещества) растворенного вещества в 1 л раствора.
Нормальность Н раствора равна числу молей эквивалентов растворенного вещества в 1 л раствора (см. раздел 6, с. 130).
Титр Т равен числу граммов растворенного вещества, находящихся в 1 мл раствора (1 мл = 1 см3). Отметим, что размерность титра и плотности совпадают.
Моляльность m раствора равна числу молей растворенного вещества, приходящихся на 1 кг растворителя.
При образовании растворов в общем случае происходит изменение свойств и растворителя, и растворенного вещества, что связано с различными силами взаимодействия. Их можно подразделить на две группы – неспецифические (общие для всех) и специфические (индивидуальные). К неспецифическим относят электростатическое и ион-дипольное взаимодействия, силы металлической связи, силы Ван-дер-Ваальса (силы межмолекулярного взаимодействия). Все названные взаимодействия характеризуются как дальнодействующие. К специфическим взаимодействиям относят силы химической связи (водородные, донорно-акцепторные и т.п.). Они являются короткодействующими. К короткодействующим относятся также силы отталкивания.
В растворах в разной степени имеют место физические и химические взаимодействия. Продуктами химического взаимодействия являются сольваты (в воде – гидраты), представляющие собой соединения переменного состава между частицами растворенного вещества и растворителя. Прочные сольваты удается выделить из раствора, например, кристаллогидраты.
|
|
Дата добавления: 2014-01-04; Просмотров: 3329; Нарушение авторских прав?; Мы поможем в написании вашей работы!