
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методы систематического хода анализа катионов. 7 страница
|
|
|
|
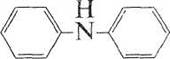
Под действием окислителей дифениламин по необратимой реакции сначала образует дифенилбензидин:
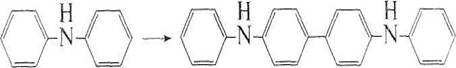 +2Н+ + 2е
+2Н+ + 2е
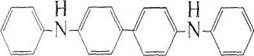
Далее бесцветный дифенилбензидин обратимо окисляется до окрашенного в интенсивный сине-фиолетовый цвет дифенилбен-зидина фиолетового:
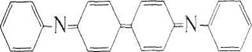 +2Н++2е
+2Н++2е
Применяют также дифениламиносульфокислоту, 1,10-фенантро -линат железа (ферроин) и др. индикаторы. Выбор осуществляют на основе кривых титрования, учитывая, что интервал перехода индикатора должен находиться в пределах скачка титрования.
ПЕРМАНГАНАТОМЕТРИЯ
Перманганатометрия - метод, основанный на использовании калия перманганата в качестве титранта для определения соеди-нений, которые обладают восстановительными своиствами.
Продукты восстановления перманганат-ионов могут быть различ-ными в зависимости от рН среды:
Ø в сильнокислой среде
+ 5е + МnО4- + 8Н+ ↔ Мn2+ + 4Н2О Е0 = 1,51 В
Ø слабокислой или нейтральной среде
+ 3е + МnО4- + 4Н+ ↔ МnО2↓ + 2Н2О Е0 = 1,69 В
Ø слабощелочной среде
+ 3е + МnО4- + 2Н2О ↔ МnО2↓ + 4ОН- Е0 = 0,60 В
Для анализа чаще всего используют окислительные свойства МnО4- - ионов в сильнокислой среде, так как продуктом их восстано-вления в этом случае являются бесцветные ионы Мn 2+ (в отличие от бурого осадка МnО2), которые не мешают наблюдать изменение окраски титруемого раствора от избыточной капли титранта. Необходимое значение рН среды создают с помощью раствора серной кислоты. Другие сильные минеральные кислоты не исполь-зуют. Так, азотная кислота сама обладает окислительными свой-ствами, и в ее присутствии становится возможным протекание побочных реакций. В растворе хлороводородной кислоты (в при-сутствии следов Fe2+) происходит реакция окисления хлорид-ионов. Титрант метода - раствор 0,1 * (0,05) моль/дм3 калия перманганата - готовят как вторичный стандартный раствор и стандартизуют по стандартным веществам: щавелевой кислоте, натрия оксалату, мышьяка (ΙΙΙ) оксиду, соли Мора (NH4)2Fe(SО4)2 ∙ 6Н2О и др.
|
|
|
Титрованный раствор калия перманганата по точной навеске кристаллического препарата приготовить невозможно, так как в нем всегда содержатся некоторое количество МnО2 и другие продукты разложения. Перед установлением точной концентрации раствор КМnО4 выдерживают в темной склянке в течение 7-10 дней. За это время происходит окисление восстановителей, присутствие которых в дистиллированной воде полностью исключить не удается (пыль, следы органических соединений и т. п.). Для ускорения этих процессов раствор калия перманганата иногда кипятят. Необходимо учитывать, что вода обладает окислительно-восстановительными свойствами и может восстанав-ливать перманганат. Эта реакция идет медленно, но МnО2 и прямой солнечный свет катализируют процесс разложения КМnО4, поэтому через 7-10 дней осадок МnО2 необходимо удалить. Раствор КМnО4 обычно осторожно сливают с осадка или фильтруют через стеклянный фильтр. Приготовленный таким образом раствор КМnО4 не слишком низкой концентрации (0,05 моль/дм3 и выше) и не изменяет титр продолжительное время. Титр раствора калия перманганата чаще всего устанавливают по безводному натрия оксалату Na2C2O4 или щавелевой кислоте Н2С2О4 ∙ 2Н2О:
МnО4- + 5НС2О4- + 11H+ ↔ 2Мn2+ + 10СО2 + 8Н2О
Первые капли перманганата даже в горячем растворе обесцве-чиваются очень медленно. В ходе титрования концентрация ионов Мn2+ возрастает, и скорость реакции увеличивается. Титр перманга-ната калия можно установить также по мышьяка (ІІ) оксиду или металлическому железу. Использование для установления титра металлического железа особенно целесообразно, если в дальнейшем предполагается перманганатометрическое опреде-ление этого элемента.
|
|
|
В пермаганатометрии применяют также растворы восстано-вителей – соли Fe (ІI), щавелевую кислоту и некоторые другие - для определения окислителей методом обратного титрования. Соеди-нения Fe (ІІ) на воздухе медленно окисляются, особенно в нейт-ральном растворе. Подкисление замедляет процесс окисления, однако обычно рекомендуют перед применением раствора Fе (II) в анализе проверить его титр. Оксалаты и щавелевая кислота в растворе медленно разлагаются:
Н2С2О4 ↔ СО2↑ + СО↑+ Н2О
Этот процесс ускоряется на свету, поэтому растворы окса-латов рекомендуется хранить в темных склянках. Подкисленные растворы оксалатов более устойчивы, чем нейтральные или щелочные.
В перманганатометрии часто обходятся без применения специального индикатора, так как сам перманганат имеет интенсивную окраску, а его избыточная капля вызывает появление неисчезающей в течение 30 с розовой окраски pacтвора. При титровании разбавленными растворами применяют редокс-индикаторы, такие как дифениламинсульфокислота или ферроин (координационное соединение Fe (ІІ) с 1,10-фенантролином). Определение конечной точки титрования выполняют также потенциометрическим или амперометрическим методами.
Перманганатометрическим методом можно определить:
Ø восстановители Н2О2, NО2, C2О42-, Fe2+ и пр.,
Ø Са 2+, Ва2+ и другие катионы в различных препаратах;
Ø МnО2, РbО2, K2Cr2O7, персульфаты и другие окислители обратным титрованием. Вторым стандартным раствором в этом случае является раствор восстановителя (чаще - щавелевой кислоты или соли Мора). При этом окислители восстанавливают титрованным раствором щавелевой кислоты или соли Мора, избыток которых оттитровывают раствором калия перманганата.
Например, при анализе свинца диоксид пробу растворяют в сернокислом растворе щавелевой кислоты:
МnО2 + НС2О4- + 3H+ ↔ Мn2+ + 2 СО2↑ + 2Н2О
и избыток щавелевой кислоты оттитровывают калия перманганатом.
Перманганатометрически можно определить ионы, не обладающие окислительно-восстановительными свойствами (титрование заместителя). Этим методом могут быть определены, например, катионы кальция, стронция, бария, свинца, цинка и другие, которые образуют малорастворимые оксалаты.
|
|
|
Анализ органических соединений. Окисление органических соединений калия перманганатом происходит с небольшой скоро-стью, что сдерживает практическое применение этого метода для анализа органических веществ. Тем не менее некоторые органиче-ские вещества можно с успехом определять этим методом, исполь-зуя восстановление MnO4- в щелочной среде. Органические соеди-нения при этом обычно окисляются до карбоната. По окончании peaкции восстановления перманганата в щелочной среде раствор подкисляют и титруют MnO4- раствором железа (ІІ) или другого подходящего восстановителя. Так определяют, например, метанол, который в щелочной среде окисляется калия пермаганатом по схеме:
СН3ОН + 6MnO4- + 8ОН- ↔ СО32- + 6MnO42- + 6Н2О
Этим методом можно определить также муравьиную, винную, лимонную, салициловую и другие кислоты, глицерин, фенол, формальдегид и другие органические соединения.
Перманганатометрия является фармакопейным методом анализа.
ХРОМАТОМЕТРИЯ (ДИХРОМАТОМЕТРИЯ)
Дихроматометрия - метод определения, основанный на окислении веществ дихромат-ионами. В его основе лежит полуреакция:
+ 6е + Сr2О72- + 14Н+ ↔ 2Сг3+ + 7Н2О Е0 = 1,33 В;
f (К2Сr2О7) = 1/6.
в кислой среде К2Сr2О7 является сильным окислителем, следова-тельно, этим методом возможно определение целого ряда неорганических и органических восстановителей, например Fe2+, [Fe(CN)6]4-, SO32-, метанола, аскорбиновой кислоты и др.
Кислую среду при титровании обычно создают с помощью раст-воров серной или ортофосфорной кислот. Можно использовать и раствор НСl при ее концентрации, не превышающей 2 моль/дм3, так как в этих условиях хлорид - ионы не окисляются дихромат- иона-ми до хлора.
Титрантом метода является раствор 0,1 моль/дм3 К2Сr2О7.
Поскольку К2Сr2О7 является стандартным веществом, из него готовят титрант первичной стандартизации.
Определение конечной точки титрования в этом методе проводят следующим образом:
Ø без индикатора - по изменению окраски титруемого раствора при добавлении избытка титранта (переход зеленого цвета Сг3+ в желто-зеленый). Метод является ненадежным;
|
|
|
Ø с помощью редокс-индикаторов, таких как дифениламин, фенилантраниловая кислота, дифениламиносульфокислота и др.;
Ø инструментальными методами - потенциометрией.
При определении восстановителей, например Fe2+, протекает следующая реакция:
- е + Fe2+ ↔ Fe3+ 6 Е0 = 0,771 В;
+ 6е + Сr2О72- + 14Н+ ↔ 2Сг3+ + 7Н2О 1 Е0 = 1,33 В
Fe2+ + Сr2О72- + 14Н+ → 6Fe3+ + 2Сг3+ + 7Н2О
f (Fe2+) = 1
В качестве индикатора используют натрия фениламиносульфонат, при этом окраска раствора в момент эквивалентности изменяется от зеленой до фиолетовой.
Растворы калия дихромата следует хранить в закрытой посуде в темном месте. В этих условиях титр раствора остается стабильным в течение продолжительного времени.
ЦЕРИМЕТРИЯ
Метод основан на окислительных свойствах катионов Се4+. В его основе лежит полуреакция:
Се4+ +е ↔ Се3+ Е0(средаНСlО4)= 1,70 В; Е0(НNO3) = 1,61 В;
f(Се4+) = 1 Е0(средаН2SО4)= 1,44 В; Е0(НCl) = 1,28 В.
Таким образом, ионы церия (IV) по окислительным свойствам близки к перманганату. Анализ цериметрическим методом проводят в кислой среде. При этом следует иметь в виду, что потенциал редокс-пары Се4+ / Се3+ в значительной мере зависит от природы используемой кислоты, анионы которой входят в состав комплексов с катионами.
Титрантами метода являются растворы 0,1 и 0,01 моль/дм3 церия (IV) сульфата Ce(SО4)2 ∙ 4Н2О или церий (ΙV)-аммония сульфата [Ce(SО4)2 ∙ 2(NH4)2SО4] ∙ 2Н2О, которые готовят как титранты вторичной стандартизации. Стандартизуют титранты по стандартным веществам - раствору Na2C2О4 или (NН4)2С2О4.
Обычно готовят титрованные растворы церия (IV) сульфата. При их приготовлении прибавляют определенное количество серной кислоты, чтобы растворы имели рН ≤ 1. Это препятствует гидро-лизу с образованием малорастворимых основных солей церия и приводит к их устойчивости в течение длительного времени. Растворы, подкисленные соляной или азотной кислотой, менее устойчивы в результате разложения воды.
Конечную точку титрования определяют следующим образом:
Ø без индикатора - по изменению окраски титруемой смеси (метод ненадежен);
Ø с помощью редокс-индикаторов, таких как дифениламин, ферроин и др.;
Ø с помощью кислотно-основных индикаторов метилового оранжевого, метилового красного (в момент эквивалентности происходит необратимое окисление индикатора титрантом и соответственно происходит изменение окраски);
Ø инструментальными методами - потенциометрией, амперо-метрией.
Метод используют для определения восстановителей:соединений олова (П), мышьяка (III), сурьмы (IП), железа (П), Н2О2, йодидов, нитритов и др. Определяют также органические вещества: фенолы, углеводы, щавелевую кислоту, аскорбиновую кислоту.
 ОН O
ОН O
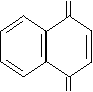 СН3 СН3
СН3 СН3
+ 2Сe(SО4)2 → +Ce2 (SО4)3 +H2SO4
 ОН O
ОН O
При определении Fe2+ протекает следующая реакция:
- е + Fe2+ ↔ Fe3+ 1 Е0 = 0,77 В;
+ е + Се4+ → Се3+ 1 Е0 = 0,45 В
Fe2+ + Се4+ → Fe3+ + Се3+
f (Fe2+) = 1
При титровании применяют редокс-индикатор ферроин, при этом окраска раствора в момент эквивалентности изменяется от красной до синей. К достоинствам метода относятся: высокий окислительно-восстановительный потенциал пары Се4+ / Се3+, возможность проводить определения в присутствии хлоридов (в отличие от перманганатометрии). В качестве недостатка следует отметить невозможность определения в нейтральной и щелочной средах.
БРОМАТОМЕТРИЯ
Метод основан на окислительных свойствах КвrО3:
+ 6е + ВrО3- + 6Н+ ↔ Br- + 3Н2О Е0 = 1,45 В; (1)
f(КвгО3) = 1/6.
Уравнение (1) свидетельствует о том, что реальный окислительно-восстановительный потенциал пары ВrО3- /Br- зависит от концентрации ионов Н+. В связи с этим бромат используют в качестве окислителя в сильнокислой среде (рН ≤ 1).
Например, окисление арсенитов в кислой среде броматом протекает по уравнению:
3Н3AsО3 + КвrО3 ↔ 3Н3АsО4 + KBr
f(КвгО3) = 1/6.
Следует отметить, что бромат-ионы в сильнокислой среде окисляют бромид-ионы, образующиеся по уравнению (1), до свободного брома - по ypaвнению (2):
+ 10е + 2ВrО3- + 12Н+ ↔ Вr2 + 6Н2О 1 Е0 = 1,52 В; (2)
- 2е + 2Вr - ↔ Вr2 5 Е0 = 1,087 В
ВrО3- + 5Вr- + 6Н+ → 3Вr2 + 3Н2О
Однако этот процесс протекает тогда, когда бромид - ионы являются более активными восстановителями по сравнению с определяемыми. В этом случае бромат-бромидная смесь ведет себя как раствор брома. Свободный бром всегда образуется в конечной точке титрования броматом и вызывает изменение окраски индикатора.
При броматометрических определениях имеют дело обычно с реакцией (2). Поэтому часто вводят бромиды в титруемый раствор или в титрованный раствор калия бромат (бромат-бромидный метод, или броматометрия). Его широко используют для количественного определения органических соединений (аромати-ческих аминов, фенолов). При этом происходит бромирование органических соединений. Раствор, содержащий бромат - и бромид - ионы, в кислой среде ведет себя как раствор брома и применяется для определения ароматических аминов и фенолов. Определение основано на реакции бромирования органических соединений.
Например, при определении стрептоцида протекает реакция:

К анализируемому раствору, содержащему стрептоцид, добавляют H2SО4, раствор КВг, индикатор метиловый оранжевый и титруют стандартным раствором КВгО3 до исчезновения розовой окраски. Титрантом метода является раствор 0,1 моль/дмЗ калия бромата КВгО3. Так как КвгО3 является стандартным веществом, из него готовят титрант первичной стандартизации.
Конечную точку титрования в броматометрии определяют с помощью индикаторов метилового оранжевого или метилового красного, которые обесцвечиваются избыточной каплей титранта в результате их необратимого окисления бромом в конечной точке титрования.
Методом броматометрии определяют следующие органические соединения: фенол, резорцин, салициловую кислоту, стрептоцид и др.
Аналитическая химия - лекция №12
ЙОДОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ. ТИТРАНТЫ, ИХ СТАНДАРТИЗАЦИЯ. ФИКСИРОВАНИЕ КОНЕЧНОЙ ТОЧКИ ТИТРОВАНИЯ. ОПРЕДЕЛЕНИЕ ОКИСЛИТЕЛЕЙ И ВОССТАНОВИТЕЛЕЙ.
НИТРИТОМЕТРИЯ.
Метод йодометрии основан на окислительно-восстановительных свойствах редокс-системы [I3]- / 3I-:
+2е + [I3] - ↔ 3I- Е0 ([I3] - / 3I -) = 0,545 В
Величина потенциала указанной полуреакции свидетельствует о том, что [I3] - является окислителем средней силы, а ион I - - восстановителем средней силы. Поэтому метод используют для определения ряда восстановителей, окисляя их стандартным раствором І2, а также определения ряда окислителей, восстанавли-вая их раствором KI.
Выделившийся в последнем случае свободный йод оттитровывают стандартным раствором Nа2S2О3. Например, при определении K2Cr2О7 калия йодид реагирует с ним по следующей схеме:
+ 6е + Cr2О72- + 14Н+ ↔ 2СгЗ+ + 7Н2О 1 Е0 = 1,33 В;
- 2е + 3I- ↔ [I3]- 3 Е0 = 0,545 В
Cr2О72- + 14Н+ + 9I- → 2СгЗ+ + 7Н2О + [I3] –
Выделившийся йод оттитровывают стандартным раствором Nа2S2О3:
+2е + [I3]- ↔ 3I- 1 Е0 = 0,545 В;
-2е + 2S2О32- ↔ S4О62- 1 Е0 = 0,09 В
[I3]- + 2S2О32- ↔ 3I- + S4О62-
Титрантами метода являются растворы 0,05-0,01 моль/дм3 I2 в КI и растворы 0,05-0,1 моль/дм3 Nа2S2О3. Тиосульфат-ион S2О32- является восстановителем. В реакциях с йодом онокисляется до тетратионат-иона:
- 2е + 2S2О32- ↔ S4О62- Е0 = 0,09 В.
Готовят вторичный стандартный раствор Nа2S2О3, так как крис-таллический Nа2S2О3 ∙ 5Н2О не является стандартным веществом ввиду содержания кристаллизационной воды и неустойчивости его при хранении. Приготовленный раствор Nа2S2О3 выдерживают в течение 7-10 дней, так как Nа2S2О3 реагирует с СО2, содержащимся в воде, и с кислородом воздуха по
схемам (1 и 2):
S2О32- + СО2 + Н2О ↔ НSО3- + S↓ + НСО3- (1)
2S2О32- + О2 ↔ SО42- + 2S↓ (2)
Это приводит к изменению концентрации титранта. В связи с тем что указанные процессы ускоряются на свету, раствор Na2S2О3
необходимо хранить в посуде из темного стекла. Вследствие того что титрант разлагают тиобактерии, для предотвращения, этого разложения к раствору прибавляют антисептик HgI2.Однако раствор Na2S2О3 можно стандартизовать через 1-2 дня, если приго-товить его на свежепрокипяченной воде или добавить при его пpи-готовлении 1 г Nа2СОЗ на 1 л раствора для подавления реакции (1).
Раствор йода можно приготовить как первичный стандартный раствор, поскольку йод легко можно получить в химически чистом виде сублимацией (твердой возгонкой). Ввиду того что концентрация раствора йода при хранении уменьшается из-за его летучести, целесообразно готовить раствор как титрант вторичной стандартизации, используя обычный йод.
Так как кристаллический йод плохо растворим в воде, его навеску растворяют в концентрированном растворе KI в соотношении 1: 2 или 1: 3. При этом образуется растворимый в воде комплексный ион [I3]-, который имеет красно-коричневую окраску:
I2 + I3 - ↔ [I3] -
Ионы I-, входящие в состав титрованного раствора йода, могут окисляться кислородом до свободного йода, что при водит к возрастанию его концентрации. Этот процесс протекает на свету, при повышении температуры, а также ускоряется присутствием каталитических количеств тяжелых, металлов:
6I - + О2 + 4Н+ ↔ 2Н2О
Поэтому его раствор необходимо хранить в посуде из темного стекла, а поскольку йод летуч, то посуда должна быть с притертой пробкой.
Стандартизовать раствор йода можно:
а) по стандартному раствору ВаS2О3 и Аs2О3;
б) стандартному раствору Nа2S2О3.
Конечную точку титрования в йодометрии можно определить следующим образом:
Ø без индикатора, так как раствор І2 в KI имеет интенсивную коричневую окраску и избыточная капля титранта окрашивает раствор в светло-желтый цвет. Для повышения чувствительности определения конечной точки титрования в этом случае в раствор можно прибавить растворители, не смешивающиеся с водой (бензол, хлороформ или тетрахлорметан), которые экстрагируют йод и окрашиваются в красно-фиолетовый цвет;
Ø на практике для повышения чувствительности определения используют специфический индикатор крахмал, который адсорбирует І2, образуя продукт синего цвета. При титровании восстановителей раствором йода крахмал добавляют сразу и титруют до появления синей окраски. Если титруют раствор йода раствором Nа2S2О3, крахмал прибавляют после того как основная масса йода оттитрована и раствор приобретет светло-желтую окраску. Раствор продолжают титровать Nа2S2О3 до обесцвечивания синей окраски индикатора. Тогда как прибавление крахмала в начале титрования приводит к получению завышенных результатов. (Йод, адсорбированный крахмалом в значительных количествах, медленно взаимодействует с Nа2S2О3, что приводит к перетитрованию).
При выполнении йодометрических определений необходимо соблюдать следующие условия титрования:
1. Титрование проводят в нейтральной или слабокислой среде, так как в щелочной - происходит реакция диспропорционирования йода:
I2 + 2ОН- ↔ ΙО - + Ι- + Н2О
а в сильнокислой среде разлагается Nа2S2О3:
S2О32- + 2Н+ → Н2S2О3 → S↓ + SО2↓ + Н2О
2. Титрование необходимо проводить на холоде, так как йод - летучее вещество; повышение температуры приводит также к понижению чувствительности индикатора крахмала.
Методом йодометрии возможно определение восстановителей SО32- S2О32-, АsО2 - стандартный редокс-потенциал которых меньше Е0([I3]-/ 3Ι-).
Определение восстановителей проводят методом прямого титрования раствором йода. В качестве индикатора применяют крахмал, который добавляют в ализируемый раствор в начале титрования и титруют раствором йода до появления синей окраски раствора.
Рассмотрим определение восстановителей на при мере определения NaAsО2. При определении протекает реакция:
-2е + AsО2 + 2Н2О ↔ НАsО42- 1 Е0 = 0,56 В;
+2е + [I3]- ↔ 3Ι- 1 Е0 = 0,545 В
АsО2- + [I3]- + 2Н2О → НАsО43- + 3Н+ + 3Ι-
Поскольку потенциалы обеих пар близки, возможно протекание реакции в обратном направлении. Для того чтобы реакция протекала в прямом направлении, необходимо связывать образующиеся Н+ -ионы. Этого добиваются добавлением NаНСО3. При этом сохраняется рН ~ 7...8. При таком рН репотенциал пары АsО43-/АsО2- уменьшается (Е0 = - 0,71 В), реакция протекает в прямом направлении достаточно полно:
-2е + AsО2 + ОН- ↔ АsО43- + 2Н2О 1 Е0 = -0,71 В;
+2е + [I3]- ↔ 3Ι- 1 Е0 = 0,545 В
АsО2- + [I3]- + 4ОН- ↔ АsО43- + 2Н2О + 3Ι - f (NaAsО2) = 1/2
Если реакция взаимодействия восстановителей с раствором I2 протекает медленно (S2-, глюкоза, антипирин и др.), то применяют обратное титрование. В этом случае к восстановителям добавляют избыток стандартного раствора йода и через некоторое время остаток йода оттитровывают раствором натрия тиосульфата. В этом случае индикатор крахмал добавляют в конце титрования
Определение окислителей методом йодометрии возможно, если их окислительно-восстановительный потенциал больше потенциала пары [I3]- / 3Ι- (например, КМnО4, K2Cr2О7, КвгО3, Н2О2, Сu2+ и др.). Так как при прямом титровании окислителей раствором KI невозможно визуально зафиксировать точку эквивалентности, а реакция между окислителем и Nа2S2О3 протекает нестехио-метрично, то для определения окислителей применяют метод замещения. В этом случае окислитель замещают эквивалентным количеством йода, который оттитровывают стандартным раствором Nа2S2О3. Замещение окислителей проводят по схеме:
а) стадия замещения: окислитель + Н+ + I - → [I3] -
б) стадия титрования: [I3] - + 2S2О32- → 3I - + S4О62-
Условия заместительного титрования:
1. Необходим КI для растворения выделившегося йода и уменьшения его летучести.
2. После добавления КI смесь в посуде с притертой пробкой выдерживают некоторое время в темном месте для завершения реакции.
3. Индикатор крахмал добавляют в конце титрования Определение окислителей рассмотрим на примере определения Сu2+. Сu2+ - это окислитель, следовательно, его определяют йодометрически по методу замещения. При этом протекает реакция:
+ е + Сu2+ ↔ Сu + 2 Е0 (Сu2+/Сu+) = 0,167
- 2е + 3I - ↔ [I3] - 1 Е0 ([I3]-/ 3I-) = 0,545 В
2Сu2+ + 3I- ↔ 2Сu+ + [I3]-
Судя по величинам стандартных потенциалов, реакция должна протекать в обратном направлении. Однако концентрация [Сu+] в растворе сильно понижается ввиду образования осадка CuI, а стандартный потенциал пары Сu2+/СuI становится равным 0,886 В, что превышает стандартный потенциал пары [I3]-/ 3I-, и реакция протекает в прямом направлении:
+ е + Сu2+ ↔ СuI↓ 2 Е0 (Сu2+/СuΙ↓) = 0,886 В;
- 2е + 3I- ↔ [I3]- 1 Е0 ([I3]-/ 3I-) = 0,545 В
2Сu2+ + 5I- → 2СuI↓ + [I3]-
[I3]- + 2S2О32- ↔ 3I- + S4О62- fэкв(Сu2+) = 1.
Методом йодометрии возможно определение кислот, при этом протекает следующая реакция:
+ 10е + 2IO3- + 12Н+ ↔ І2 + 6Н2О 1
- 2е + 2І- ↔ І2 5
2IO3- + 12Н+ + 2І- ↔ 6І2 + 6Н2О
IO3- + 6Н+ + 5І- ↔ 3І2 + 3Н2О
Из уравнения реакции видно, что количество выделившегося вещества йода равно половине количества ионов водорода, вступивших в реакцию. При определении сильных кислот к анализируемому раствору кислот добавляют раствор, содержащий КIО3 и КІ, и выделившийся йод титруют стандартным раствором Nа2S2О3. При определении слабых кислот применяют обратное титрование. Для этого к анализируемому раствору кислоты добавляют смесь КIО3 и КІ, а также избыток стандартного раствора Nа2S2О3, а через некоторое время остаток Nа2S2О3 оттитровывают раствором йода.
Определение оксикислот (например винной, лимонной) проводят йодо- метрическим методом в присутствии ионов кальция, магния и других, которые образуют с оксикислотами устойчивые комплек-сные соединения. В этих условиях оксикислоты титруют так же, как и сильные кислоты.
ЙОДХЛОРИМЕТРИЯ.
Йодхлориметрические исследования основаны на окислительных свойствах йода монохлорида ICl согласно уравнению реакции:
+ 2е + ICl ↔ І - + Сl - Е0 (ICl/I-) = 0,795 В
fэкв(ICl) = 1/2
и применяются для определения восстановителей.
В конце титрования при добавлении избытка ICl к оттитрованной смеси выделившиеся І - -ионы окисляются раствором ICl до І2:
ICl + І - ↔ І2 + Сl -
Йодхлориметрические определения аналогичны йодометрическим, однако имеют преимущества:
а) потенциал редокс-пары ICl/I - больше, чем пары [I3] -/ 3I -. Это расширяет возможности метода;
б) стандартный раствор ICl более устойчив по сравнению с раствором І2.
В качестве титранта метода применяют раствор 0,1 моль/дмЗ ICl, который готовят как вторичный стандартный раствор. Раствор IСl готовят окислением КI с помощью КIО3 в среде концентриро-ванной НСl:
- 2е + I- + Сl- ↔ IСl 2
+ 4е + IО3- + 6Н+ + Сl- ↔ IСl + 3Н2О 1
2 I- + IО3- + 6Н+ + 3Сl- ↔ 3IСl + 3Н2О
Стандартизуют ICl по стандартным веществам ВаS2О3, К4[Fe(CN)6], гидразина сульфату и по стандартному раствору Nа2S2О3.
В йодхлориметрии конечную точку титрования определяют следующим образом:
Ø без индикатора по собственной окраске І2 или в присутствии opгaнических растворителей, не смешивающихся с водой;
Ø с индикатором крахмалом - в конце титруемый раствор окрашивается в синий цвет;
Ø электрохимическими методами - потенциометрическим титрованием амперометрическим титрованием.
Методом ICl можно определить восстановители SO32-, НSO3-, Sn2+, аскорбиновую кислоту. Например, в основе определения натрия сульфита лежат следующие реакции, представленные уравнениями: - 2е + SO32- + 4Н2О ↔ SO42- + 2Н+ 1 Е0 = 0,17 В;
+ 2е + ICl ↔ I- + Сl- 1 Е0 = 0,795 В
SO32- + Н2О + ICl ↔ SO42- + 2Н+ + I - + Сl -
f(Nа2SО3) = 1/2
Этим методом определяют также органические вещества, спос-бные вступать в реакции йодирования (например фенолы, анилин, сульфаниламидные препараты) согласно схеме:

 OH OH
OH OH
+ 3IСl → + 3НСl
I I
I
fэкв(орг. в-во) = 1/6
Преимуществом раствора ICl по сравнению с раствором І2 в последнем случае является необратимость реакции, так как в результате реакции вместо НI выделяется НСl и процесс становится необратимым.
НИТРИТОМЕТРИЯ.
За основу метода взяты окислительно-восстановительные, диазотирующие нитрозирующие свойства NaNО2 (в кислой среде). Поэтому им можно определить:
Ø окислители Н2О2, КМnО4, активный хлор в хлорной извести, которые окисляют нитрит-ионы до нитрат-ионов согласно уравнению:
-2е + HNО2 + Н2О ↔ NОЗ - + 3Н+ Е0 = 0,94 В;
Ø восстановители Sn2+, Fe2+, которые восстанавливают NО2 - до NO:
+ е + HNО2 + Н+ ↔ NO↑ + Н2О Е0 = 1,20 В;
Ø производные первичных и вторичных ароматических аминов.
NaNО2 (в среде НСl) может вступать в реакцию диазотирования с первичными ароматическими аминами с образованием солей диазония:
R - NH2 + NaNО2 + 2НС1 ↔ [R-N ≡N]Сl- + NaC1 + 2Н2О
Вторичные амины взаимодействуют с нитритом натрия с образо-ванием N-нитрозоаминов:
RR1NH + NaNO2 + НС1 ↔ RR1N-NO↓ + Н2О + NaC1
Титрантом метода является раствор 0,lмоль/дмЗ NaNО2, который готовят к вторичный стандартный раствор, ввиду того что кристаллический NaNО2 гигроскопичен и содержит в растворе примеси NаNО3. Приготовленный раствор NaNО2 хранят в посуде из темного стекла с притертой пробкой.
Стандартизуют раствор NaNО2:
а) по стандартным веществам (сульфаниловая кислота);
б) стандартному раствору КМnО4.
Конечную точку титрования в нитритометрии фиксируют с помощью внешних и внутренних индикаторов, а также потенциометрически.
В качестве внешнего индикатора применяют йодкрахмальную бумагу, которая в момент эквивалентности окрашивается в синий цвет.
В качестве внутренних индикаторов используют обратимые редокс-индикаторы: тропеолин 00 с метиленовым синим - окраска изменяется от фиолетовой к синей. Метиленовый синий выполняет роль фона, на котором четче видно изменение окраски тропеолина 00. Нитритометрический метод анализа широко используют для определения многих лекарственных препаратов, содержащих первичную аминогруппу, например стрептоцида.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 542; Нарушение авторских прав?; Мы поможем в написании вашей работы!