
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Принципіальні схеми абсорбції
В хімічній техніці використовують наступні принципові схеми абсорбційних процесів: прямоточні, протиточні, одноступінчаті з рециркуляцією і багатоступінчасті з рециркуляцією.
Прямоточна схема взаємодії речовин в процесі абсорбції показано на рис.9.5.1. В цьому випадку струми газу і абсорбенту рухаються паралельно один до одного; при цьому газ з з більшою концентрацією речовини, що розподіляється, приводиться в контакт з рідиною, що має меншу концентрацію речовини, що розподіляється, а газ з меншою концентрацією взаємодіє на виході з апарату з рідиною, яка має більшу концентрацію речовини, що розподіляється.
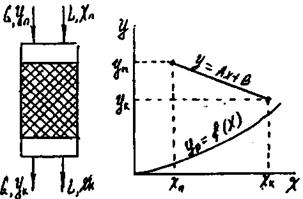
Рис.9.5.1.Прямоточна схема абсорбції.
Протиточна схема показана на рис.9.5.2. За цією схемою в одному кінці апарату приводяться в контакт газ і рідина, які мають великі концентрації речовини, що розподіляються, а в протилежному кінці - менші.
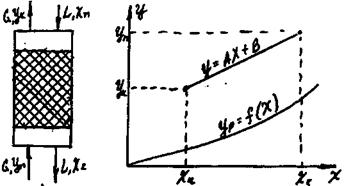
Рис. 9.5.2 Протиточна схема абсорбції.
Схеми з рециркуляцією передбачають багатократне повернення в апаратуру або рідини, або газу. Схема з рециркуляцією рідини показана на рис.9.5.3.

Рис.9.5.3 Схема абсорбції з рециркуляцією рідини.
Газ проходить через апарат знизу вгору, і концентрація речовини, що розподіляється в ньому змінюється від Уп до Ук. Рідина яка поглинає підводиться до верхньої частини апарата при концентрації речовини, що розподіляється Хn, потім змішується з рідиною яка виходить з апарату, як результат відбувається підвищення концентрації до Хс. Робоча лінія зображується на діаграмі відрізком прямої; крайні точки його мають координати Yп, YK і Хк , Хп відповідно. Величину Хс легко знайти з рівняння матеріального балансу.
Позначимо відношення кількості поглинаючої рідини на вході в апарат до кількості свіжої поглинаючої рідини через ni, тоді
G(Yп-Yк) = L(Хк-Хn) = L(Хк-Хc ), (9.5.1)
і
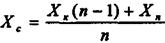 (9.5.2)
(9.5.2)
Схема абсорбції з рециркуляцією газу приведена на рис.8.5.4. Тут матеріальні співвідношення аналогічні попереднім. Положення робочих ліній визначають точки Ас (Yc, Хк ) і В (Yк, Хп); ордината Yс знаходиться з рівняння матеріального балансу:
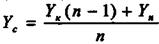 (9.5.3)
(9.5.3)
Одноступінчаті схеми з рециркуляцією можуть бути як протиточні, так і прямоточні.
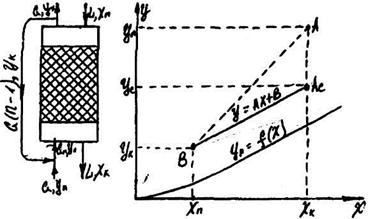
Рис. 9.5.4. схема абсорбції з рециркуляцією газу.
Багатоступінчасті схеми з рециркуляцією можуть мати прямоток, протиток, рециркуляцію рідини і рециркуляцію газу. Велике практичне значення має багатоступінчаста протиточна схема з рециркуляцією рідини в кожному ступені. Ця схема показана на рис. 9.5.5.


Рис. 9.5.5. Схема багатоступінчастої абсорбції з рециркуляцією рідини.
Робочі лінії наносяться на діаграму окремо для кожного ступеня, як і у випадку декількох окремих одноступінчатих апаратів. У розглянутому на рисунку прикладі робочі лінії складають відрізки А1В1, А2В2, A3B3.
Співставимо розглянуті схеми абсорбції, враховуючі наступні показники процесу: питому витрату абсорбенту, рушійну силу процесу і коефіцієнти масопередачі. На рис.9.5.6 показані прямоточні протиточні процеси при заданих їх параметрах: Уп, Ук і Xп.


Рис.9.5.6. Рушійна сила прямоточного (а) і протиточного (б) процесів абсорбції.
На рисунках показані також граничні положення робочих ліній, коли концентрації Х`к для прямого току і Х"K для протитоку досягають рівноважних значень. З приведених графіків видно, що Х"K>Х'к а ΔY"m < ΔY'm.
Тому протиточний процес забезпечує більшу кінцеву концентрацію газу, що поглинається, в абсорбенті, а разом з цим і меншу витрату абсорбенту; рушійна сила при протитоці менша, а тому при інших рівних умовах необхідні більші розміри апарата. Вказане співвідношення носить загальний характер і його можна формувати як: зміна робочих концентрацій, яка призводить до зменшення витрати абсорбенту, потребує збільшення габаритів апарата, і навпаки.
Одноступінчаті з рециркуляцією абсорбенту або газу порівняно зі схемами без рециркуляції мають наступні особливості. При одній і тій же витраті свіжого абсорбенту кількість рідини, яка проходить через апарат, значно більше; як результат цього є збільшення коефіцієнта масопередачі і деяке зменшення рушійної сили. При певному співвідношенні між дифузійними опорами в рідкій і газовій фазах це може призвести до зменшення габаритів апарата.
Очевидно, що рециркуляція рідини доцільна у тому випадку, якщо основний опір масопередачі складає перехід речовини від поверхні розділу фаз в рідину, а рециркуляція газу - коли основним опором процесу є перехід речовини з газової фази до поверхні розділу фаз. Рециркуляції рідини завжди віддається перевага при необхідності супроводжувати процес абсорбції охолодженням, так як в цьому випадку включення холодильника в галузь рециркулюючого абсорбенту дозволяє досить легко відводити тепло від взаємодіючих речовин.
Багатоступінчасті схеми з рециркуляцією мають всі переваги одноступінчатих схем і разом з тим забезпечують більшу рушійну силу процесу. З цієї причини в більшості випадків вибирають варіант багатоступінчастих рециркуляційних схем.
10 Перегонка рідин
Вступ
Перегонка рідин являє собою процес, в якому рідка суміш, що розділяється, нагрівається до кипіння, а пар, що утворився відбирається і конденсується. В результаті отримуємо рідину, склад якої відрізняється від складу вихідної суміші.
Розділення перегонкою базується на різній летючості компонентів суміші при одній і тій же температурі. Тому при перегонці всі компоненти суміші переходять в пароподібний стан в кількостях, пропорційних їх фугітивності.
В багатьох випадках вихідна суміш є бінарною, тобто складається з двох компонентів. Пар, що отримується при її перегонці містить відносно кількість легколетючого, або низькокиплячого, компонента (НК), ніж вихідна суміш. Тому, в процесі перегонки рідка фаза збіднюється, а парова фаза збагачується НК. Рідина, що не випарувалася, має склад більш багатий важко летючим, або висококиплячим компонентом (ВК).
Ця рідина називається залишком, а рідина, отримана в результаті конденсації парів, -дистилятом, або ректифікатом.
Ступінь збагачення парової фази НК при інших рівних умовах залежить від виду перегонки. Існує два принципово різних вида перегонки:
1) проста перегонка (дистиляція);
2) ректифікація.
Дистиляція (проста перегонка) являє собою процес одноразового часткового випаровування рідкої суміші і конденсації парів, що утворюються.
Значно більш повніше розділення рідких сумішей на компоненти досягається шляхом ректифікації.
Ректифікація являє собою процес багатократного часткового випаровування рідини і конденсації парів. Процес здійснюється шляхом потоку пару і рідини, які мають різну температуру, і проводяться звичайно в колонних апаратах. При кожному контакті з рідини випаровується переважно НК, котрим збагачуються пари, а з парів конденсуються переважно ВК, які переходять в рідину. Такий двосторонній обмін компонентами, що повторюється багато раз, дозволяє отримати в кінцевому рахунку пари, які являють собою майже чистий НК. Ці пари після конденсації в окремому апараті дають дистилят (ректифікат) і флегму - рідину, яка повертається для зрошення колони і взаємодії з парами, що піднімаються. Пари отримують шляхом часткового випаровування знизу колони залишку, є майже чистим ВК.
Процеси перегонки здійснюються періодично або безперервно.
10.1 Характеристики двофазних систем рідина - пар
Якщо система складається з двох компонентів (К=2) і між ними не проходить хімічна реакція, то при наявності рідкої та парової фаз число фаз Ф=2. Згідно правилу фаз, число ступенів свободи такої системи складне:
С=К+2-Ф=2+2-2=2
Тому, з трьох незалежних параметрів, які повністю визначають стан системи: температури t, тиску Р і конденсації С - можна довільно вибрати будь - які два; при цьому визначиться значення третього параметра, котре вже не може бути довільним.
У зв'язку з цим для фізико-хімічної характеристики бінарних систем рідина - пар користуються так званими фазовими діаграмами. Якщо позначити через X склад рідкої фази, а через У - склад парової фази, то, приймаючи t=const, можна побудувати графік залежності тиску пару від складу рідини (діаграма Р-х). Аналогічно, вважаючи постійним тиск парів (P=const), зображують на площині залежність температури кипіння рідини і конденсації парів від складу рідкої та парової фаз (діаграма t-x-y). При P=const t=const знаходять залежність між рівноважними складами фаз, котра зображується діаграмою рівноваги (діаграма у-х).
Вигляд цих залежностей визначається взаємною розчинністю компонентів рідкої суміші і іншими їх властивостями.
Класифікація бінарних сумішей
В залежності від взаємної розчинності компонентів розрізняють суміші рідин:
-з необмеженою взаємною розчинністю;
-взаємно нерозчинні;
-обмежено розчинні один в одному.
Суміші з необмеженою взаємною розчинністю компонентів в свою чергу поділяються на ідеальні суміші з позитивним або від'ємним відхиленням від закону Рауля.
|
Дата добавления: 2014-01-04; Просмотров: 655; Нарушение авторских прав?; Мы поможем в написании вашей работы!