
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основне рівняння масопередачі
|
|
|
|
Загальні відомості про масообмінні процеси.
Технологічні процеси, швидкість проходження котрих визначається швидкістю переносу речовини (маси) з однієї фази в іншу, називають масообмінними процесами, а апарати, які призначені для проведення цих процесів, - масообмінними апаратами.
В розділяючому агрегаті можуть проводитись різні процеси. Основними і найважливішими з них є абсорбція, ректифікація, екстракція, кристалізація, адсорбція, сушка, іонообмінні процеси і мембранне розділення. Крім перерахованих основних процесів розділення слід зазначити і такі, як термодифузія, зонна плавка та ін.
Для всіх перелічених процесів загальним є перехід загальним є перехід речовини з однієї фази в іншу, або масопередача.
Масопередачею називають перехід речовини з однієї фази в іншу в напрямку досягання рівноваги.
В масообміні в більшості випадків приймають участь три речовини: розподіляюча речовина (або речовини), що складає першу фазу; розподіляюча речовина (або речовини), яка складає другу фазу; розподіляюча речовина (або речовини), котрі переходять з однієї фази в другу.
При переносі речовини з однієї фази в іншу змінюється концентрація. Так як концентрація пропорційна числу частинок, то, отже, швидкість переходу розподіляючої речовини з однієї фази в іншу пропорційна різниці міжфактичною
концентрацією розподіляючої речовини в даній фазі і рівноважній концентрацією.
Основний закон масопередачі можна сформувати, виходячи з загальних кінетичних закономірностей хіміко-технологічних процесів: швидкість процесу рівна рушійній силі діленій на опір, тобто
 , (7.2.1)
, (7.2.1)
де 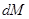 - кількість речовини, яка перейшла з однієї фази в іншу;
- кількість речовини, яка перейшла з однієї фази в іншу;
|
|
|
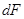 - поверхня фазового контакту;
- поверхня фазового контакту;
 -час;
-час;
 - рушійна сила масообмінного процесу
- рушійна сила масообмінного процесу 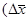 і
і 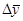 )
)
R - опір.
Якщо замість R взяти зворотню величину К - коефіцієнт швидкості або, як його називають в розглядаючому явищі, коефіцієнт масопередачі, попереднє набуде вигляду:
 (7.2.2)
(7.2.2)
В випадку, коли dM віднесено до одиниці часу, рівняння (7.2.2) можна переписати у вигляді
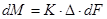 (7.2.3)
(7.2.3)
Рівняння (7.2.2) і (7.2.3) називають основними рівняннями масопередачі.
В апаратурі, яка використовується для проведення масообмінних процесів, рівноважні концентрації розподіляючої речовини ніколи не досягаються. Дійсні концентрації розподіляючої речовини, або робочі концентрації, завжди відрізняються від рівноважних. Різниця між цими концентраціями, характеризує ступінь відхилення від рівноваги, і являє собою рушійну силу масообмінних процесів.
Існування певної фази в системі, або рівновага фаз можлива лише в певних умовах. Можливість існування даної фази в рівновазі з іншими визначається правилом фаз, або законом рівноваги фаз Гіббса:
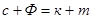 (7.2.4)
(7.2.4)
де с - число ступенів свободи (тиск, температура, концентрація) - мінімальне число параметрів, котре можливо змінювати незалежно один від одного, не порушуючи рівновагу даної системи;
Ф - число фаз системи;
k - число незалежних компонентів системи;
n - число зовнішніх факторів, що впливають на положення рівноваги в даній системі.
Для процесів переносу маси n=2, так як зовнішніми факторами в цьому випадку є температура і тиск. Тоді вираз (7.2.4) набуває вигляду С+Ф=k+2. Звідки С=k-Ф+2. Таким чином, правило Гіббса дозволяє визначити число параметрів, котре можна змінювати, не порушуючи фазової рівноваги системи.
Залежність між параметрами будують в плоских координатах (температура - концентрація, тиск - концентрація). Такі діаграми називають фазовими.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 5487; Нарушение авторских прав?; Мы поможем в написании вашей работы!