
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Жидкости
Конденсированное состояние вещества.
Адиабатический (изэнтропический) процесс
Изотермический процесс
Изобарический процесс
Изохорический процесс.
Для изохорического процесса
V= const → dV=0 → δA=0 → δQ = dU =νCV·dT
Q = νCV·ΔT (4.4.15)
Для изобарического процесса
P= const → δQ= dU+ δA = νCV·dT + νRdT = νCРdT
Q = νCР·ΔT (4.4.16)
Для изотермического процесса
T= const → dT=0 → dU=0 → δQ = δA
Q=A=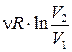 (4.4.17)
(4.4.17)
Для адиабатического (изэнтропического) процесса
S =const 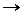 δQ = 0 → δA = - dU
δQ = 0 → δA = - dU
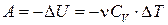 (4.4.17)
(4.4.17)
Область существования вещества в жидком состоянии ограничена со стороны высоких температур переходом его в газообразное состояние, а со стороны низких температур — переходом в твердое состояние — кристаллизацией.
По своим физическим свойствам жидкости занимают промежуточное положение между газами и твердыми телами. Жидкости, как и твердые тела, способны сохранять свой объем и у них существует свободная поверхность. В то же время жидкости, подобно газу, принимают в поле силы тяжести форму того сосуда, в который они налиты. Как и газы, жидкости обладают текучестью, а подобно твердым телам, они имеют очень малую сжимаемость и способны сопротивляться растяжению.
Малая сжимаемость жидкостей обусловлена тем, что им присуще довольно сильное межмолекулярное взаимодействие. Поэтому в жидкости даже небольшое уменьшение взаимных расстояний между молекулами приводит к появлению больших сил отталкивания. Коэффициент сжимаемости жидкостей, характеризующий относительное изменение объема жидкости при увеличении внешнего давления на единицу, изменяется в пределах от 2·10-1 до 2·10-2 Па. Так, например, для воды он равен 4,53·10-1 Па. С увеличением давления коэффициент сжимаемости жидкости уменьшается, так как по мере того как жидкость сжимается, уменьшаются расстояния между ее молекулами и увеличиваются силы отталкивания между ними. Это и затрудняет дальнейшее сжатие жидкости.
Наоборот, с повышением температуры коэффициент сжимаемости возрастает, так как при нагревании объем жидкости, а, следовательно, и расстояние между ее молекулами увеличиваются. При этом силы отталкивания между молекулами уменьшаются, и сжатие жидкости облегчается.
Изучение рассеяния рентгеновских лучей, нейтронов и электронов в жидкости показывает, что ближайшие соседи каждой молекулы жидкости располагаются в определенном порядке, образуя структуру, сходную со структурой твердого тела. Однако уже на расстояниях порядка трех-четырех молекулярных диаметров сходство утрачивается. Это и послужило основанием к употреблению для жидкости термина ближний порядок в. отличие от дальнего порядка, имеющего место в кристаллах. Было также, установлено, что с повышением температуры упорядоченность в расположении соседних молекул жидкости постепенно уменьшается и, слёдовательно, их расположение становится все более хаотическим.
Промежуточное положение жидкости между газами и твердыми телами проявляется в том, что эти оба состояния являются предельными для вещества в жидком состоянии. Именно с этим и связана особая сложность свойств жидкого состояния вещества и те большие трудности, которые возникают при разработке его теории.
При изучении свойств жидкости используют по существу средние величины такие, как, например, средняя энергия взаимодействия молекул и средняя энергия их теплового движения, среднее взаимное расположение частиц жидкости и т. п. Это привело к применению статистических методов для описания тех или иных свойств жидкости и к разработке статистической теории жидкости.
Однако при использовании статистической теории для расчета свойств жидкостей возникают большие трудности в учете межмолекулярных взаимодействий в конкретных жидкостях.
Тепловое движение в жидкости, вдали от критической точки, имеет следующий характер. Каждая молекула в течение некоторого времени колеблется около определенного положения равновесия. Затем скачком перемещается в новое положение равновесия, отстоящее от предыдущего на расстоянии, примерно равном размеру самой молекулы. Таким образом, молекулы лишь медленно перемещаются внутри жидкости, пребывая часть времени около определенных мест, находясь в «оседлом» состоянии. Среднее время «оседлого» существования молекул называют временем релаксации. Оно резко убывает с повышением температуры жидкости, при этом подвижность молекул сильно возрастает.
При перескоке молекулы из одного временного положения равновесия в другое нарушаются ее связи с соседними молекулами, и, следовательно, затрачивается энергия. Иначе говоря, при перескоке в новое временное положение равновесия молекула должна преодолеть потенциальный барьер высотой, создаваемый взаимодействием ее со старыми соседями. Эту минимальную энергию, необходимую для перемещения молекулы в новое временное положение равновесия, называют энергией активации W. Средняя кинетическая энергия молекул жидкости, обусловленная их тепловым движением, не намного меньше энергии активации, поэтому благодаря флуктуациям она в некоторые моменты времени оказывается достаточной для того, чтобы молекула смогла перескочить в новое временное положение равновесия.
Среднее время релаксации 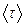 связано с энергией активации W соотношением
связано с энергией активации W соотношением
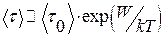 (4.7.1)
(4.7.1)
где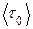 - средний период колебания молекулы около временного положения равновесия, k - постоянная Больцмана, Т - абсолютная температура.
- средний период колебания молекулы около временного положения равновесия, k - постоянная Больцмана, Т - абсолютная температура.
Средний период колебания молекулы имеет порядок 10-12 с, а время релаксации для обычных маловязких жидкостей оценивается примерно в 10-11с. Время релаксации зависит от природы жидкости, ее температуры и для разных жидкостей может оказаться самым различным, но всегда меньшим среднего периода.
Специфический механизм теплового движения молекул в жидкости позволяет объяснить двойственный характер свойств жидкости по отношению к внешним силовым воздействиям.
Если время действия внешней силы больше времени релаксации, то молекулы жидкости совершают скачки преимущественно в направлении действия силы, т.е. возникает поток молекул в этом направлении, обусловливающий ее текучесть. Если время действия внешней силы меньше времени релаксации, то молекулы жидкости не успевают изменить свои положения временного равновесия и текучесть жидкости не успевает проявиться. Жидкость в этом случае подобно упругой среде оказывает сопротивление изменению не только ее объема, но и формы. При очень кратковременном действии внешней силы может даже произойти нарушение прочности жидкости, т. е. могут появиться трещины, разломы и т. д.
В соответствии с описанным выше механизмом теплового движения в жидкости зависимость вязкости жидкости от температуры определяется формулой
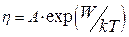 (4.7.2)
(4.7.2)
где множитель А зависит от природы жидкости и до некоторой степени от ее температуры.
Формула (4.7.2), впервые выведенная Я. И. Френкелем, показывает, что вязкость жидкости при повышении температуры уменьшается, в то время как для газов растет пропорционально 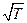 (см. формулу 4.2.29). Объясняют это тем, что для газов вязкость в основном определяется скоростью хаотического теплового движения молекул. В противоположность этому, в жидкостях вязкость определяется подвижностью молекул, во многом зависящей от действия межмолекулярных сил. Вязкость жидкостей зависит также и от давления и быстро возрастает с его увеличением. Это объясняют тем, что при повышении давления возрастает энергия активации и соответственно увеличивается время релаксации.
(см. формулу 4.2.29). Объясняют это тем, что для газов вязкость в основном определяется скоростью хаотического теплового движения молекул. В противоположность этому, в жидкостях вязкость определяется подвижностью молекул, во многом зависящей от действия межмолекулярных сил. Вязкость жидкостей зависит также и от давления и быстро возрастает с его увеличением. Это объясняют тем, что при повышении давления возрастает энергия активации и соответственно увеличивается время релаксации.
Величину η-1, обратную вязкости жидкости, принимают за меру текучести жидкости и называют текучестью жидкости.
При понижении температуры вязкость некоторых жидкостей возрастает настолько, что они практически перестают течь и превращаются в аморфные тела (см.п. 4.7.4).
Для многих жидкостей вязкость связана простой зависимостью с удельным объемом V жидкости:
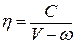 , (4.7.3)
, (4.7.3)
где ω — предельный объем молекул жидкости, а следовательно,
(V -ω) — свободный объем. Экспериментально было установлено, что значение ω близко к постоянной b в уравнении Ван-дер-Ваальса. Постоянная С в этой формуле учитывает силы межмолекулярного взаимодействия жидкости и играет роль, аналогичную постоянной а в уравнении Ван-дер-Ваальса.
|
|
Дата добавления: 2013-12-12; Просмотров: 1589; Нарушение авторских прав?; Мы поможем в написании вашей работы!