
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства. 1. Нагревание аммиака с алкилгалогенидами (реакция Гофмана) приводит к образованию смеси солей первичных
|
|
|
|
Получение
1. Нагревание аммиака с алкилгалогенидами (реакция Гофмана) приводит к образованию смеси солей первичных, вторичных и третичных аминов, которые дегидрогалогенизируются под действием аммиака или оснований.
NН3 ––С2Н5Br® [С2Н5NН3]+Br - ––NН3® С2Н5NН2 + NН4Br
C2H5NН2 ––С2Н5Br® [(С2Н5)2NН2]+Br - ––NН3® (С2Н5)2NН + NН4Br
(C2H5)2NН ––С2Н5Br® [(С2Н5)3NН]+Br - ––NН3® (С2Н5)3N + NН4Br
Смеси аминов разделяют перегонкой, используя большие различия в температурах кипения. Алкилировать аммиак можно также спиртами (Al2O3; 300°C).
2. Восстановление нитросоединений обычно используют для получения первичных аминов ароматического ряда (реакция Зинина).
 NO2 + 6[H] ®
NO2 + 6[H] ®  NH2 + 2H2O
NH2 + 2H2O
Атомарный водород образуется в момент выделения в результате реакции цинка (или алюминия) с кислотой или щелочью.
1. Основность аминов обусловлена способностью атома азота присоединять протон к неподеленной паре электронов с образованием катиона аммониевого типа. Основность аминов измеряется константой равновесия реакции гидратации:
| ..R-NH2 + H2O «[RN+H3]OH- «[RN+H3] + OH- |
Kb = ([RN+H3][OH-]) / [RNH2]
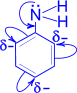
При этом наблюдается щелочная среда водного раствора. Основность амина тем выше, чем больше электронная плотность на атоме азота.
Благодаря донорному влиянию (+ I- эффекту) алкильной группы алкиламины имеют большую плотность электронов на атоме азота, чем аммиак и, следовательно, большую основность (см. значения Кb в таблице).
Ароматические амины (анилин, толуидины и др.) вследствие сопряжения неподеленной пары электронов атома азота с p- электронами бензольного ядра являются более слабыми основаниями, чем аммиак и алифатические амины.
Амины реагируют с минеральными кислотами образуя соли аммониевого типа:
|
|
|
| ..RNH2 + HCl ® [RNH3]+Cl- |
RR'NH + HCl ® [RR'NH2]+Cl-
RR'R"N + HCl ® [RR'R"NH]+Cl-
| H-O | O |
| R-NH2 + | \ // S ® [R-NH3]+[OSO3H]- / \\ |
| H-O | O |
2. Алкилирование аминов галогеналканами приводит к солям аммония.
CH3-NH2 + C2H5Br ® [CH3-NH2-C2H5]+Br -(метилэтиламмонийбромид)
| CH3 I NH + C2H5Cl ® [ I CH3 | CH3 I NH–C2H5]+Cl-(диметилэтиламмонийхлорид) I CH3 |
Под действием щелочей эти соли разлагаются до соответствующих аминов, например:
[СН3-NH2-СН2-СН2-CH3]+I-(метилпропиламмониййодид) + NaOH ®
® СН3-NH-СН2-СН2-CH3 + NaI + H2O
3. Ацилирование аминов производными карбоновых кислот (галогенангидридами, ангидридами) дает N- замещенные амиды:
| СН3- | O II C I | O II | |
| Cl+ H | -N- C2H5® CH3- | C-NH-C2H5 + HCl | |
| хлорангидрид уксусной кислоты | I H | N- этиламид уксусной кислоты |
| O II CH3 -C \ | O II | O II | ||||
| O + H- | N | 
| ® CH3-C-NH | 
| + CH3–C-OH | |
| / CH3-C II O | I H | |||||
| уксусный ангидрид | N- фениламид уксусной кислоты (ацетанилид) |
4. Горение. Амины сгорают в кислороде, образуя азот, углекислый газ и воду.
4CH3NH2 + 9O2 ® 4CO2 + 10H2O + 2N2
4C2H5NH2 + 15O2 ® 8CO2 + 14H2O + 2N2
5. Аминогруппа оказывает существенное влияние на бензольное кольцо, вызывая увеличение подвижности водородных атомов по сравнению с бензолом, причем, вследствие сопряжения неподеленной электронной пары с p- электронной ароматической системой, увеличивается электронная плотность в орто- и пара- положениях.
При нитровании и бромировании анилин легко образует 2, 4, 6 - тризамещенные продукты реакции.
По той же причине анилин легко окисляется. На воздухе аналин буреет; при действии других окислителей образует вещества разнообразной окраски. С хлорной известью CaOCl2 дает характерное фиолетовое окрашивание. Это одна из наиболее чувствительных качественных реакции на анилин.
Окислением анилина хромовой смесью (K2Cr2O7 + H2SO4) получают краситель для ткани "Анилиновый черный".
|
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 464; Нарушение авторских прав?; Мы поможем в написании вашей работы!