
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кинетика микробиологических процессов
|
|
|
|
В основе процессов обмена клетки со средой и внутреннего метаболизма лежит сложная сеть организованных определенным образом во времени и пространстве различных реакций. В результате этих процессов изменяются концентрации различных веществ, численность отдельных клеток, биомасса организмов, могут изменяться и другие величины, например величина трансмембранного потенциала в клетке. Изменения всех этих переменных величин во времени и составляют кинетику биологических процессов. Таким образом: кинетика изучает закономерности протекания во времени биохимических процессов, механизмы биохимических превращений в зависимости от различных факторов (температуры, концентрации реагирующих веществ, давления, рН среды).
Все гомогенные элементарные химические реакции различают по числу молекул, участвующих в элементарном акте химического взаимодействия. По этому признаку реакции подразделяют: мономолекулярные, бимолекулярные и тримолекулярные.
Порядок реакции по данному веществу — показатель степени при концентрации этого вещества в кинетическом уравнении реакции.Если зависимость скорости химической реакции от концентраций исходных веществ записать в виде:
V = k [A1]n1[A2]n2…………[Ah]nk
где n1 -порядок реакции по веществу A1, а (n1+ n2 + ……..+ nk) - порядок реакции в целом.
Выделяют реакции 0, 1, 2, 3 – порядков.
Химические реакции 0 порядка. Кинетическое уравнение имеет следующий вид:
V0 = k0
Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ. Нулевой порядок характерен, например, для гетерогенных реакций в том случае, если скорость диффузии реагентов к поверхности раздела фаз меньше скорости их химического превращения. Диаграмма зависимости скорости химической реакции от концентрации субстрата при химической реакции 0 порядка:
|
|
|
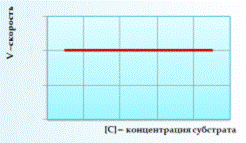
Рисунок 1. Зависимость скорости реакции от концентрации 0 порядка
Химические реакции 1 порядка. Кинетическое уравнение имеет следующий вид:
V1 = k1[C]
Диаграмма зависимости скорости химической реакции от концентрации субстрата при химической реакции 1 порядка:
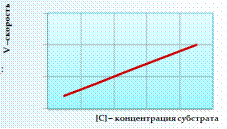
Рисунок 2. Зависимость скорости реакции от концентрации 1 порядка
Химические реакции 2 порядка. Кинетическое уравнение имеет следующий вид:
V2 = k2[Cа]2 или V2 = k2[Cа] [Cб]
Диаграмма зависимости скорости химической реакции от концентрации субстрата при химической реакции 2 порядка:
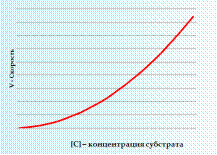
Рисунок 3. Зависимость скорости реакции от концентрации 2 порядка
Правило Вант-Гоффа - эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале (обычно от 0 °C до 100 °C). Я. Х. Вант-Гофф на основании множества экспериментов сформулировал следующее правило: при повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза.
Правило Вант-Гоффа имеет ограниченную область применимости. Ему не подчиняются многие реакции, происходящие при высоких температурах, очень быстрые и очень медленные реакции. Правилу Вант-Гоффа также не подчиняются реакции, в которых принимают участие громоздкие молекулы, например белки в биологических системах.
Распределение молекул в системе по скоростям, а следовательно, и по энергиям описывается кривой Максвелла-Больцмана. Отношение количества молекул n, обладающих энергией EA, к общему количеству молекул N равно:
n/N = e-Ea/RT
Уравнение, связывающее константу скорости реакции, количество столкновений молекул, энергию активации и температуру, называется уравнением Аррениуса:
|
|
|
K = p Z e-Ea/RT
где Z – количество столкновений, р – стерический фактор, предоставляющий собой вероятность столкновения молекул активными центрами.
Таким образом, энергия активации — это энергетический барьер, который преодолевают молекулы для осуществления реакции. В уравнении Аррениуса множитель определяет долю молекул, имеющих энергию и эффективно участвующих в реакции. Чем выше энергия активации реакции, тем медленнее она протекает при заданной температуре.
Зависимость скорости (v) ферментативной реакции от концентрации субстрата [S] выражается уравнением Михаэлиса-Ментен и в графической форме:
V = Vmax [S] Km + [S]
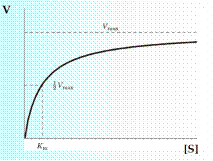
Рисунок 4. Кривая Михаэлиса-Ментен
При достаточно малых концентрациях субстрата скорость V пропорциональна [S] и ферментативная реакция представляет реакцию первого порядка. При очень больших концентрациях субстрата, когда [S] > Km, V = Vmax, и процесс идет как реакция нулевого порядка.
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 1150; Нарушение авторских прав?; Мы поможем в написании вашей работы!