
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термодинамика гальванического элемента
|
|
|
|
Рассмотрим окислительно-восстановительную реакцию, протекающую в гальваническом элементе:
аА + bВ D сС + dD
При проведении данной реакции в условиях, максимально приближенных к обратимым можно экспериментально определить многие термодинамические характеристики данного процесса. Для того чтобы процесс протекал обратимо, он должен идти с бесконечно малой скоростью через бесконечно большое число стадий. Этого можно достигнуть, увеличив сопротивление проводника, соединяющего электроды. В этом случае реакция будет протекать медленно, а процесс будет приближаться к обратимому.
В обратимом процессе совершается максимальная электрическая работа, которая при р, Т = const равна убыли свободной энергии Гиббса:
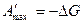 ,
,
с другой стороны в соответствии с законом Фарадея электрическая работа равна
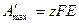 ,
,
Где z – число электронов, принимающих участие в реакции;
E – ЭДС гальванического элемента;
F – число фарадея.
Согласно уравнению изотермы химической реакции:
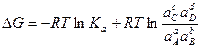 ,
,
где Ка константа равновесия реакции;
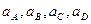 - неравновесные активности реагентов.
- неравновесные активности реагентов.
Тогда
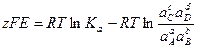
С учетом этого решим уравнение относительно Е:
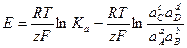 .
.
Обозначим первое слагаемое в уравнении через Е0:
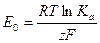 ,
,
тогда получаем
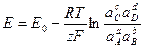 –
–
уравнение Нернста для ЭДС гальванического элемента,
где Е 0 – стандартная ЭДС гальванического элемента, то есть значение ЭДС цепи при равенстве единице термодинамических активностей ионов и молекул, принимающих участие в химической реакции, лежащей в основе работы данного элемента.
На основе измерения ЭДС при различных температурах можно рассчитать изменение термодинамических функций для реакции, лежащей в основе работы элемента.
Константа равновесия реакции равна
|
|
|
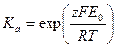 .
.
Изменение энергии Гиббса равно
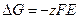 .
.
Если измерить ЭДС при нескольких температурах, то можно определить производную 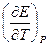 и можно рассчитать изменение энтропии:
и можно рассчитать изменение энтропии:
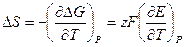
и энтальпии
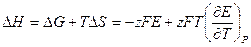
|
|
|
|
|
Дата добавления: 2013-12-11; Просмотров: 739; Нарушение авторских прав?; Мы поможем в написании вашей работы!