
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реакция нулевого порядка
|
|
|
|
Основы формальной кинетики кинетика необратимых реакций
Это реакции, скорость которых не зависит от концентрации реагирующих веществ. Основной закон химической кинетики для реакции нулевого порядка записывается:
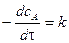
Разделим переменные и проинтегрируем в
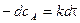 ,
,
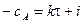 ,
,
где i – константа интегрирования.
Если τ = 0, то 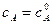 – начальная концентрация вещества А в момент времени
– начальная концентрация вещества А в момент времени
τ = 0, тогда константа интегрирования равна:
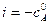
С учетом этого решим уравнение относительно k:
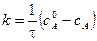 .
.
Зная константу скорости реакции, можно рассчитать концентрацию реагирующих веществ в любой момент времени:
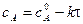
Для характеристики скорости реакции применяется понятие времени полупревращения или полураспада τ1/2. Это есть время, за которое прореагирует половина взятого количества вещества. С учетом того, что 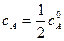 получим
получим
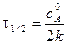
Время полупревращения реакции нулевого порядка прямо пропорционально концентрации исходного вещества.
Реакция 1 порядка: А ® В.
Пусть объем реакционной смеси равен V. Пусть в начальный момент времени τ = 0 в реакционной смеси содержится а моль вещества А и 0 моль вещества В. В момент времени τ в реакционной смеси а – х моль вещества А и х моль вещества В.
Уравнение скорости химической реакции 1 порядка имеет вид
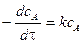 .
.
Концентрация вещества А равна
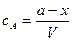 ,
,
тогда
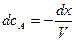 .
.
Подставим в уравнение и разделим переменные:
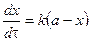 ,
,
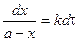 .
.
Из последнего уравнения следует, что скорость реакции 1 порядка не зависит от объема реакционной смеси.
Проинтегрировав, получим
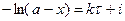 ,
,
где i – константа интегрирования.
При τ = 0 – х = 0, тогда
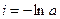
С учетом этого решим уравнение относительно k:
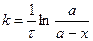 .
.
Разделив числитель и знаменатель на V, получим
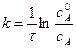 ,
,
Решим уравнение относительно 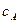 :
:
|
|
|
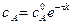 .
.
Время полупревращения реакции 1 порядка равно
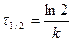 .
.
Как видно, время полупревращения реакции 1 порядка не зависит от концентрации исходного вещества и обратно пропорционально константе скорости реакции.
Реакция 2 порядка: A + B ® C + D.
Пусть в объеме реакционной смеси V в начальный момент времени
(τ = 0) содержится а моль вещества А и b моль вещества В, а вещества С и D отсутствуют. В момент времени τ по х моль веществ вступило в реакцию и образовалось по х моль веществ С и D, то есть в реакционной смеси а – х моль вещества А, b – х моль вещества В, х моль вещества С и х моль вещества D.
Запишем уравнение для скорости реакции
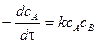
Текущие концентрации реагирующих веществ:
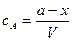 ;
; 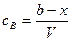 .
.
Производная от 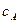 равна
равна
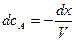 ,
,
тогда
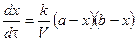 .
.
Скорость реакции 2 порядка обратно пропорциональна объему реакционной смеси. Преобразуем уравнение:
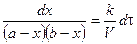 (*);
(*);
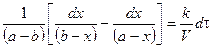
Проинтегрируем в неопределенных пределах
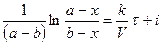 .
.
При τ = 0 – х = 0, тогда
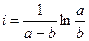
Подставим значение константы интегрирования и решим уравнение относительно k:
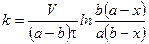
Поделим на V числитель и знаменатель правой части уравнения, а дробь, стоящую под знаком логарифма на V2, получим
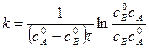 ,
,
где 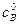 – исходная концентрация вещества В.
– исходная концентрация вещества В.
Полученное уравнение неприменимо для случая, когда 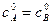 . Рассмотрим этот случай. Если a = b, то уравнение (*) запишется в виде:
. Рассмотрим этот случай. Если a = b, то уравнение (*) запишется в виде:
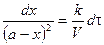
После интегрирования получим
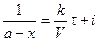
При τ = 0 – х = 0, тогда
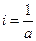 .
.
Подставим и решим уравнение относительно k:
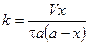 .
.
Поделим на V2:
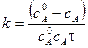 .
.
Текущую концентрацию вещества А можно рассчитать по формуле:
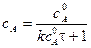 .
.
Время полупревращения вещества для реакции 2 порядка при a = b рассчитывается по уравнению:
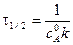 .
.
|
|
|
|
|
Дата добавления: 2013-12-11; Просмотров: 838; Нарушение авторских прав?; Мы поможем в написании вашей работы!