
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение состояния потока и взаимозависимость физических параметров потока
|
|
|
|
Уравнение неразрывности движущегося потока (Уравнение Л. Эйлера)
Уравнение состояния среды и взаимозависимость физических параметров потока
Состояние газа, как рабочего тела, характеризуется определенными значениями па-раметров состояния: давлением (p), температурой (Т) и удельным объемом(w) или массо-вой плотностью(ρ).
Используя основное уравнение молекулярно-кинетической теории газов можно уста-новить взаимосвязь между параметрами состояния идеального газа в любом термодинами-ческом состоянии.
Изменение хотя бы одного из параметров приводит к изменению остальных пара-метров.
В общем виде связь между термодинамическими параметрами может быть представ-лена зависимостью: f (p,T,w,ρ)=0
Зависимость, связывающая параметры состояния газа называется уравнением сос-тояния газа и имеет вид:
p*w=RТ или 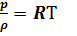 и ρ*w = 1
и ρ*w = 1
Где
p -давление газа, Па;
w -удельный объем, 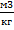 ;
;
Т -температура газа, 0 К;
ρ -массовая плотность, 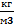 ;
;
R=287,14 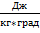 , газовая постоянная, характеризует природу конкретного газа и не зависит от параметров его состояния.
, газовая постоянная, характеризует природу конкретного газа и не зависит от параметров его состояния.
Уравнение получено путем объединения частных законов Бойля-Мариотта и Гей-Люссака в общий закон и оно получило название уравнения Клайперона-Менделеева.
Для определения состояния идеального газа достаточно знать только два его пара-метра (p и w,ρ) или (p и Т) или (w,ρ и Т) третий параметр определяется из уравнений:
Т= 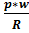 ;w=
;w= 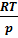 ; p=
; p= 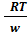 ; ρ=
; ρ= 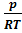 ;
;
Решение уравнения упрощается, если один из параметров состояния газа сохраняет-ся постоянным:
1 Для изохорического процесса: w = const, p2 = p1* 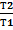
2 Для изобарического процесса: p = const, w2 = w1* 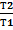
3 Для изотермического процесса Т = const, p2 = p1* 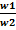
|
|
|
4 Для адиабатического процесса Q = 0; p2 = p1*( 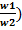 ; w2 = w1*(
; w2 = w1*( 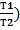 ; Т2 = Т1*(
; Т2 = Т1*( 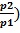
Наибольший интерес представляет определение параметра по двум другим извест-ным параметрам, которые можно определить при помощи определённых инструменталь-ных приборов. Например, при давлении p =760 мм. рт. ст. (10332 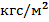 ) температура T=15
) температура T=15  C, плотность воздуха согласна уравнению состояния равна:
C, плотность воздуха согласна уравнению состояния равна:
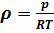 =
= 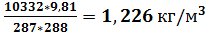
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 638; Нарушение авторских прав?; Мы поможем в написании вашей работы!