
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение состояния идеального газа
|
|
|
|
Уравнение состояния – устанавливает связь между параметрами состояния. В простейшем случае равновесное состояние тела определяется P, V, T. Связь между ними аналитически можно выразить так:
F(P, V, T) = 0
где F – некоторая функция параметров.
Это - уравнение состояния газа.
При обычных условиях параметры состояния многих газов хорошо описываются уравнением
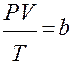
где b – константа, пропорциональная массе газа.
Это уравнение выполняется точно для идеального газа.
Идеальный газ – газ, молекулы которого не взаимодействуют друг с другом и имеют пренебрежимо малый объём. Молекулы соударяются друг с другом абсолютно упруго.
Если ввести молярный объём 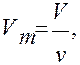 где ν – количество вещества и учесть, что
где ν – количество вещества и учесть, что
m = m0NAν =µν
где m0 – масса одной молекулы.
µ - молекулярная масса.
NA – число Авогадро,
то уравнение состояния можно записать в виде
р Vm ν = b · T или PVm = RT *
Согласно закону Авогадро при одинаковых давлениях и температурах молярные объёмы Vm различных газов одинаковы.(Vm = 22.4·10-3м3) при Н.У.
Из этого закона и уравнения * следует, что постоянная R одинакова для всех газов. Это - универсальная газовая постоянная R = 8.31 Дж/(моль۰К)
Для произвольной массы газа
* *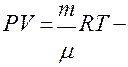 уравнение Менделеева Клапейрона,
уравнение Менделеева Клапейрона,
т.к. R = kNA, где k – постоянная Больцмана
k = 1.38 · 10-23 Дж/К из ** получаем
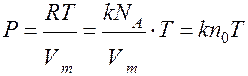
Р = kn0T
§2.4. Давление газа с точки зрения молекулярно-кинетической теории.
При своём движении молекулы газа ударяются о стенку сосуда, создавая тем самым давление.
Если газ находится в равновесии все направления движения молекул равновероятны. Если n0 – концентрация молекул (число молекул в единице объёма)
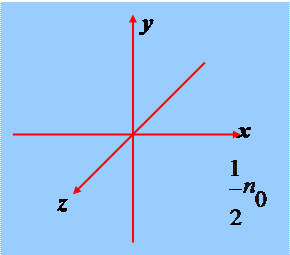

то в данном направлении движется число молекул равное
|
|
|
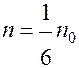 (в единице объёма).
(в единице объёма).
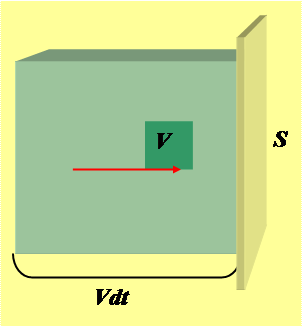

N = nVdt·S – число молекул, ударяющихся упруго о стенку за время dt. При этом
dP = 2m0V·N где m0 – масса одной молекулы и
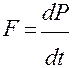 .
.
Следовательно 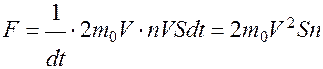
Откуда давление

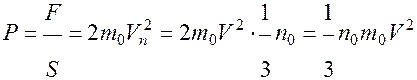
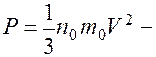 основное уравнение молекулярно-кинетической теории.
основное уравнение молекулярно-кинетической теории.
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 275; Нарушение авторских прав?; Мы поможем в написании вашей работы!