
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Диссоциация слабых кислот
|
|
|
|
Равновесие диссоциации слабых к-т и основ. Константа диссоци. З-н разбавления Оствальда. Расчет рН.
Слабые кислоты: H2S, HF, CH3COOH, HNO2 (HnЭOm m-n<2)
Слабые основания: NH4OH, Me(OH)n (Me-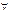 , кроме щелочных и щелочно земельных)
, кроме щелочных и щелочно земельных)
Слабые кислоты и основания диссоциируют обратимо, равновесно, по ступеням, причём каждая последующая ступень протекает слабее предыдущей. Количественно диссоциацию слабых электролитов выражают с помощью

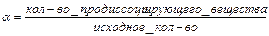
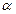 - степень электролит диссоциации Kg - константа диссоциации (константа равновесия)
- степень электролит диссоциации Kg - константа диссоциации (константа равновесия)
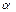 <<1 и Kд<1
<<1 и Kд<1
Слабые кислоты и сл основания диссоц-ют обратимо, равновесно, по ступеням, при чем каждая последующая ступень протекает слабее предыдущей. Количественно дис сл электролитов выражается:
α(степень эл дисс)=кол-во продисс-их/исходное кол-во
Кд – константа дисс-ии (конст равновесия)
α<<1 Кд<1
CH3COOH↔CH3COO-+Н+; 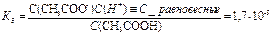
1ст. H3AsO4↔H++ H2AsO4-
Кg1= C(H2AsO4-)*C(H+)/C(H3AsO4)=6*10-3
2ст. H2AsO4↔H++ HAsO4-2
Кg2=1*10-8
3ст. HAsO4↔H++ AsO4-3
Кg3=3*10-12
Кg1> Кg2 >Кg3>
α1> α2> α3
Диссоциация сл оснований протекает аналогично
NH4OH↔NH4++OH-
Кд=1,7*10-5
pH+pOH=14; pH=-lg C(H+); pOH=14-pH pH<7 кислотная среда; pH>7 щелочная среда
Константа диссоциации.
Константа диссоциации — вид константы равновесия, которая показывает склонность к диссоциации.
Диссоциация протекает с участием полярных молекул Н2О. Чем их больше, тем в большей степени протекает диссоциация.
Закон разбавления Оствальда.
Взаимосвязь 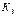 и
и 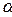 - з-н оствальда
- з-н оствальда
Закон: 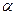 -степень эл. диссоциации слабых электролитов, увеличивается при разбавлении раствора.
-степень эл. диссоциации слабых электролитов, увеличивается при разбавлении раствора.
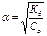 ;
; 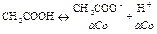
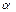 -степень эл.диссоциации слабых электролитов; Со - исх;
-степень эл.диссоциации слабых электролитов; Со - исх; 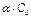 – продиссоциир. вещества
– продиссоциир. вещества
Со- 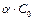 - не диссоциир. Вещества;
- не диссоциир. Вещества; 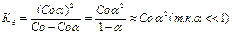
Расчет рН раствора
KВ=C(H+)C(OH-)= const (при T= const) KВ - константа ионного произведения воды
|
|
|
Значение KВ устанавливает взаимосвязь С ионов H+ и гидроксид OH – в водных растворах. По KВ можно определить среду воды и водного раствора: кислотная, щелочная KВ=10-14(при t=18оС)
Обозначения:
-lg C(H+)=рН – водородный показатель
-lg C(OH –)=рОН – гидроксидный показатель
-lg KВ= -lg 10-14=14
рН+ рОН=14; pH<7 кислотная среда; pH>7 щелочная среда
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 4736; Нарушение авторских прав?; Мы поможем в написании вашей работы!