
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Непредельные (ненасыщенные) углеводороды
|
|
|
|
Хлорметан (метилхлорид)
Как отдельные гомологи, так и изомеры отличаются друг от друга не только физическими, но и химическими свойствами.
Метан является главной составной частью природного газа газовых месторождений (до 97%) и в значительном количестве содержится в попутном нефтяном газе.
Смесь метана с воздухом крайне взрывоопасна (особенно в соотношении 1:10).
Все предельные углеводороды характеризуется сравнительно большой прочностью. Для них возможны только реакции:
1) Замещения атомов водорода по связям с С–Н,
2) Разрыва связей С–С.
Реакция метана с хлором протекает по цепному механизму и заключается в последовательном замещении атомов водорода атомами галогена
 с образованием' галогенпроизводных, например:
с образованием' галогенпроизводных, например:
СН4 + С12 = СН3С1 + НС1
СН3С1 + С12 —> СН2С12 + HCI и т. д. дихлорметан
Метан горит с выделением большого количества теплоты
СН4 + 2О2 = СО2 + 2Н2О, G = +879 кДж.
Все предельные углеводороды горят и могут быть использованы в качестве топлива.
Простейший непредельный углеводород с двойной связью —
этилен С2Н4 или СН2 = СН2 является родоначальником гомологического ряда непредельных этиленовых углеводородов:
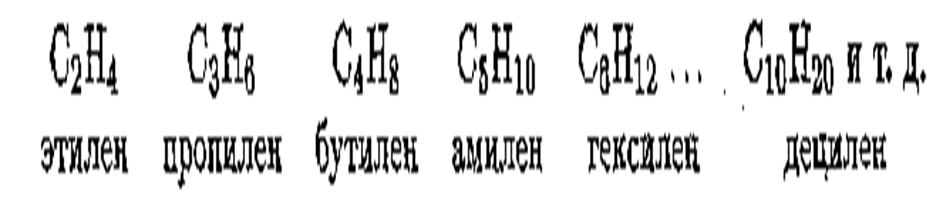
Простейший непредельный углеводород с тройной связью —
ацетилен С2Н2, или СН±СН
Из углеводородов с двумя двойными связями отметим
бутадиен (дивинил) С4Н6 и изопрен C5H8:
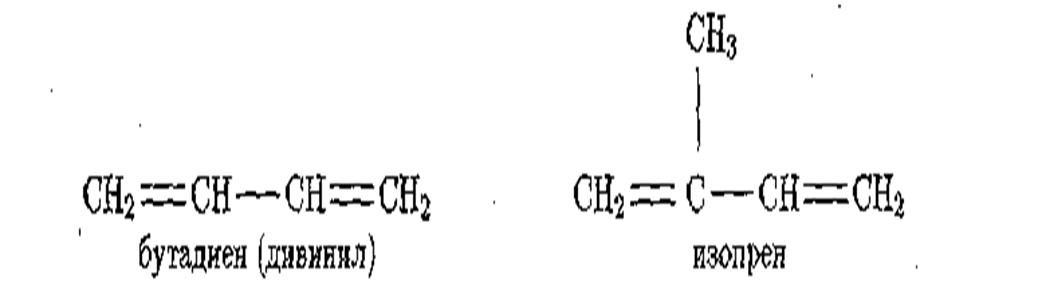
По систематической номенклатуре ИЮПАК углеводороды ряда этилена называют алкенами, с двумя двойными связями — алкадиенами, а ацетиленовые — алкинами.
Важным процессом переработки нефти является крекинг. Крекингом – процесс расщепления углеводородов с длинными цепями на молекулы меньшей длины, происходящий в присутствии катализаторов (каталитический крекинг) или при нагревании предельных углеводородов до 500—700° С под давлением {термический крекинг).
|
|
|
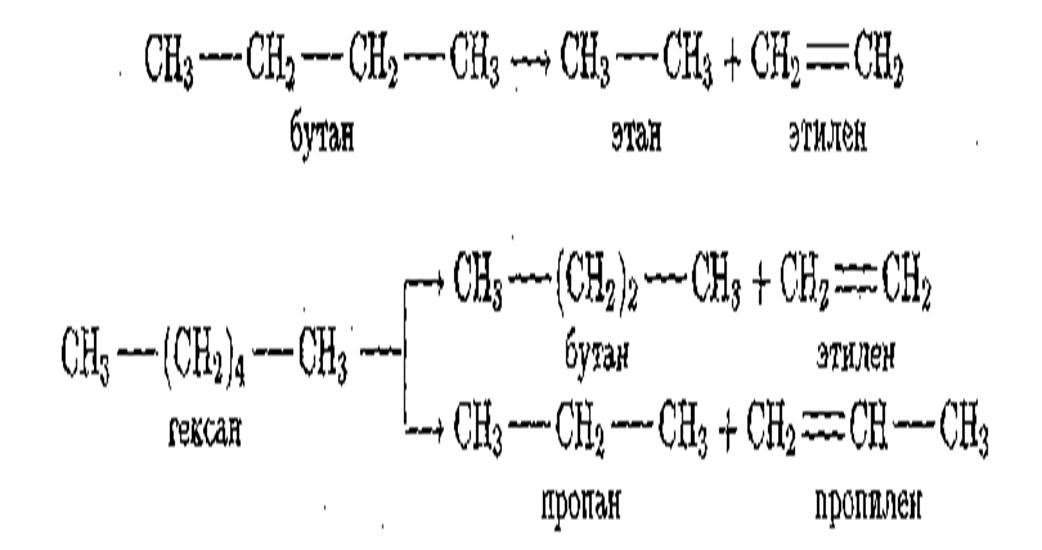
По химическим свойствам непредельные углеводороды резко отличаются от предельных; они исключительно реакционноспособны и вступают в реакции присоединения.
Так, этилен и ацетилен легко присоединяют бром
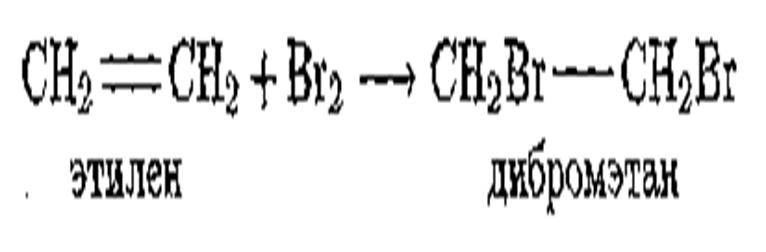
Этилен — бесцветный газ со слабым приятным запахом, довольно хорошо растворимый в воде. Его температура кипения — -103,8 °С.
Ацетилен — - бесцветный газ с характерным слабым запахом; температура кипения — 83,8°С. При его сгорании выделяется большое количество теплоты. Температура пламени достигает 3150 °С, поэтому ацетилен в смеси с кислородом широко используют для сварки и резки металлов (автогенная сварка). Взрывоопасен; смеси с воздухом, содержащие от 2,3 до 80,7% ацетилена, взрываются от искры.
Можно получать действие воды на карбид кальция СаС2.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 520; Нарушение авторских прав?; Мы поможем в написании вашей работы!