
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энтальпия. Закон Гесса. Тепловой эффект химической реакции. Следствия из закона Гесса
|
|
|
|
Энтальпия. Закон Гесса
Принцип эквивалентности теплоты и работы. Первое начало термодинамики
Если система совершает круговой процесс, т. е. выйдя из какого-то начального состояния и совершив ряд превращений, возвращается в то же самое состояние, то полное количество теплоты, сообщенное системе на протяжении этого цикла, равно совершенной ею работе:
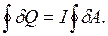 , (2.5)
, (2.5)
где I - термический эквивалент работы или механический эквивалент теплоты. Такой круговой процесс называется термодинамическим циклом.
Приведенное утверждение и его математическая форма получили название принципа эквивалентности теплоты и работы.
Он был установлен экспериментальным путем Ю. Майером (1842) и Д. Джоулем (1843).
Взаимосвязь между внутренней энергией, работой и теплотой устанавливается на основе первого начала термодинамики:
1. Запас энергии в любой изолированной системе остается постоянным.
2. Вечный двигатель первого рода невозможен, т. е. невозможно построить машину, которая бы производила механическую работу, не затрачивая на это соответствующего количества энергии.
3. Внутренняя энергия является функцией состояния.
Изменение внутренней энергии DU может происходить за счет обмена системы теплотой Q и работой А с внешней средой. Условились считать положительной теплоту, полученную системой, и работу, совершенную системой. Тогда полученная системой извне теплота Qрасходуется на приращение внутренней энергии DU и на совершение системой работы А
Q = ΔU + A;
δQ = dU + δA, (2.6)
где dU - полный дифференциал внутренней энергии системы; dQ и dА - элементарное количество теплоты и работы соответственно.
|
|
|
Примем, что единственным видом работы, которую совершает система, является работа расширения. В этом случае первое начало термодинамики примет вид:
δQ = dV = pdV. (2.7)
При V = const, dV = 0 и интегрирование уравнения дает соотношение
QV = U2 ‒ U1 = ΔU, (2.8)
т.е. теплота изохорного процесса равна приращению внутренней энергии во время этого процесса.
При р = const после интегрирования уравнения получим
Qp = (U2 + pV2) ‒ (U1 + pV1);
H = U + pV. (2.9)
Величина Н, получила название энтальпии (теплосодержания). Энтальпия является мерой энергии, накапливаемой веществом при его образовании. Энтальпия является функцией состояния, поскольку определяется через функции состояния U, р и V.
Используя введенную величину, выражение можно переписать в следующем виде:
Qp = H2 ‒H1 = ΔH, (2.10)
т.е. теплота изобарного процесса равна приращению энтальпии системы во время этого процесса.
Для бесконечно малых величин выражения будут иметь следующий вид:
δQV = dU, δQp = dH, (2.11)
С введением энтальпии теплота процесса приобретает свойство функции состояния, т. е. она не зависит от пути процесса, а определяется только начальным и конечным состояниями системы. Это утверждение, сформулированное в 1840г. русским академиком Гессом, получило название закона Гесса или закона постоянства сумм тепловых эффектов.
Тепловым эффектом химической реакции называется количество теплоты, которое выделяется или поглощается при необратимом протекании реакции, когда единственным видом работы является работа расширения.
Тепловой эффект выражают в кДж и относят к тому числу молей вещества, которое определено уравнением реакции.
Тепловой эффект химической реакции при постоянном объеме равен приращению внутренней энергии системы во время этой реакции; тепловой эффект химической реакции при постоянном давлении равен приращению энтальпии системы во время этой реакции
QV = DU, QP = DH (2.12)
|
|
|
При этом тепловой эффект эндотермической реакции (реакции, протекающей с поглощением теплоты) условились считать положительным, а тепловой эффект экзотермической реакции (реакции, протекающей с выделением теплоты) - отрицательным.
Рассмотрим тепловой эффект химической реакции образования СО2.
С + О2 = СО2 DH1 = -393 кДж/моль
С + 1/2О2 = СО DH2 = -110 кДж/моль
СО + 1/2О2 = СО2 DH3 = -283 кДж/моль
DH1 = DH2 + DH3
DH и DU отличаются на величину А работы расширения или сжатия при р = const.
DH = DU + рDV
рDV = RTDn (уравнение Клайперона - Менделеева)
DH = DU + рDV = DU + RTDn, (2.13)
где Dn – изменение количества молей газообразных веществ, определяется как разность молей газообразных продуктов и исходных веществ; R - газовая постоянная, равная 8,314 Дж/моль К.
Закон Гесса представляет собой интерпретацию первого закона термодинамики применительно к химическим и физико-химическим процессам. Он позволяет обращаться с термохимическими уравнениями, в которых приведен тепловой эффект реакции, а также и агрегатное состояние участников реакции, как с алгебраическими.
Тепловой эффект химической реакции можно вычислить по теплотам образования и теплотам сгорания.
Теплотой образования называется тепловой эффект при образовании из простых веществ одного моль соединения. При этом теплота образования простых веществ (Н2, O2, N2) принимается равной нулю.
Теплотой сгорания называется тепловой эффект (при постоянном давлении) реакции окисления кислородом одного моль химического соединения с образованием следующих продуктов реакции: CO2, SO2, H2O, N2.
По теплотам сгорания удобно рассчитывать тепловой эффект органических реакций.
Из закона Гесса вытекают три следствия:
1. Тепловой эффект химической реакции равен разности сумм теплот образования продуктов реакции и теплот образования исходных веществ с учетом их стехиометрических коэфициентов:
DН = Σ nпр Нобрпр - Σ nисх Нобрисх (2.14)
2. Тепловой эффект химической реакции равен разности сумм теплот сгорания исходных веществ и теплот сгорания продуктов реакции с учетом их стехиометрических коэфициентов:
DН= Σ nисх Нсгисх - Σ nпр Нсгпр (2.15)
3. Тепловой эффект химической реакции разложения какого либо соединения равен, но противоположен по знаку тепловому эффекту реакции его образования.
|
|
|
Поскольку тепловой эффект и энтальпия зависят от давления и температуры, то их относят к стандартному состоянию, которое определяется следующими параметрами:
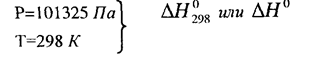
В технических расчетах используют удельную теплоту сгорания Qт,которая равна количеству теплоты, выделяющейся при сгорании 1 кг жидкого или твердого вещества и 1 м3 газообразного вещества до образования высших оксидов.
Если расчет теплоты сгорания Н0сг ведется применительно к реакции с образованием жидкой воды, то удельная теплота сгорания называется высшей, а для реакции с образованием газообразной воды – низшей. При умолчании обычно имеют в виду высшую теплоту сгорания. Например, для этанола:
Qт = 1366,7 кДж/моль (0,046 кг/моль) = 29,7 МДж/кг.
Во многих случаях расчет теплового эффекта химической реакции невозможен, поэтому его определяют экспериментально в специальных приборах, называемых калориметрами. Экспериментальное определение тепловых эффектов называют калориметрией. Калориметр представляет собой теплоизолированный сосуд, в котором может проводиться та или иная реакция. Выделяемая в результате реакции теплота передается либо воде, либо самой реакционной смеси, вызывая повышение температуры. Количество теплоты, получаемое в ходе реакции, вычисляют по уравнению:
q = [Cc + (m Cв)] DТ,
где Сс - теплоемкость сосуда калориметра (Дж ∙ К-1); Св - удельная теплоемкость реагирующей смеси или воды (Дж ∙ К-1 ∙ кг-1); т — масса реагирующей смеси или воды.
Энтальпия фазовых и полиморфных превращений. При протекании химических реакций зачастую происходят фазовые и полиморфные превращения, сопровождающиеся энергетическими эффектами.
Процессы перехода твердого тела в жидкость (плавление) и газ (сублимация), жидкости в газ (парообразование), кристаллического состояния в аморфное, менее устойчивой модификации в более устойчивую - являются эндотермическими (табл. 2.1). Обратные процессы - кристаллизации, конденсации, перехода аморфного состояния в кристаллическое, протекают экзотермически.
|
|
|
Таблица 2.1
Энергетические эффекты некоторых фазовых и полиморфных
превращений
| Превращение | Температура, К | Н0298, кДж/моль |
| Н2О(к) плавление — Н2О(ж) | 6,0 | |
| Н2О(к) сублимация — Н2О(г) | 50,03 | |
| Н2О(ж) парообразование — Н2О(г) | 40,9 | |
| Н2О(ж) парообразование — Н2О(г) | 44,0 | |
| С(графит) – С(алмаз) | 1,8 | |
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 1736; Нарушение авторских прав?; Мы поможем в написании вашей работы!