
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Образование ковалентной связи при участии неподеленных электронных пар
|
|
|
|
Рис. 16
Такая геометрическая форма вызывает разделение в пространстве «центров тяжести» отрицательного и положительного зарядов и образование диполя молекулы воды (рис. 17 СЛ 23).

Рис. 17. Электрический диполь в молекуле воды: а — проекция на плоскости; б — условное изображение
Образование ковалентной связи можно описать с помощью двух механизмов — равноценного и донорно-акцепторного. Равноценный механизм предполагает, что общая электронная пара (в методе валентных связей) образуется из неспаренных электронов обоих атомов-партнеров по связи. Донорно-акцепторный механизм образования ковалентной связи предполагает, что один из атомов предоставляет для образования связи неподеленную (собственную) пару электронов, а другой атом – вакантную (без электронов) атомную орбиталь. Атом, поставляющий пару электронов в область связывания, — это ее донор, атом, приобретающий часть электронной плотности донорной пары, — акцептор.При образовании ковалентной связи участвующие атомы могут быть, с одной стороны, как нейтральными, так и заряженными, с другой стороны — как свободными, так и уже связанными (т. е. входящими в состав молекул).
После образования связи по донорно-акцепторному механизму уже нельзя указать, какой атом был донором, а какой — акцептором электронной пары.
Пример: Молекула Н2 со связью Н—Н может образоваться (в рамках метода валентных связей) из двух атомов водорода при обобществлении двух неспаренных электронов (равноценный механизм). Однако тот же результат достигается, если исходными являются заряженные атомы Н-1 и Н+1. Атом Н-1 предоставляет для образования связи Н—Н свою неподеленную пару электронов 1s2, а атом Н+— вакантную 1s-АО (рис. 18 СЛ. 24).
|
|
|
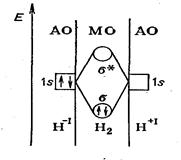
Рис. 18. Энергетическая диаграмма образования связи в молекуле Н2, исходя из атомов Н- и Н+
Молекула аммиака NН3 содержит неподеленную пару электронов у атома азота, молекула воды Н2О также имеет неподеленные пары у атома кислорода. Вместе с активным акцептором — ионом водорода Н+ по донорно-акцепторному механизму образуются катионы аммония NН4+, и оксония Н3О+ СЛ. 25:
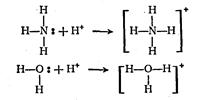
Форма молекулы NН3 (незавершенный тетраэдр) становится полностью симметричной в катионе NН4 (правильный тетраэдр); симметричность катиона Н3О+ также выше, чем у молекулы Н2О. В ионах Н3О+ и NН4+ все атомы водорода неразличимы, т, е. уже нельзя указать тот атом водорода, который был до образования связи в виде Н+ и служил акцептором электронной пары. Тип гибридизации центральных атомов О (в Н3О+) и N (в NН4+) остается тем же, что был в молекулах Н2О и NН3 (sр3-гибридизация).
Кроме того, для образовавшейся по донорно-акцепторному механизму ковалентной связи были приняты названия в простых соединениях — семиполярная, а в комплексных соединениях — донорно-акцепторная, или координационная. Поскольку ковалентные связи, образующиеся по обоим механизмам, по свойствам не различаются, указанные названия применять нецелесообразно.
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 501; Нарушение авторских прав?; Мы поможем в написании вашей работы!