
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
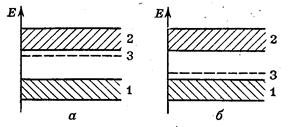
Химическая связь и строение молекул. Рис. 30. Зонная модель полупроводника, легированного n-примесью (а) или p-примесью (б)
 |
Рис. 30. зонная модель полупроводника, легированного n-примесью (а) или p-примесью (б). 1 — валентная зона основного вещества; 2 — зона проводимости основного вещества; 3 — донорный уровень n-примеси или акцепторный уровень p-примеси
Рис. 28. Расположение валентной зоны (1) и зоны проводимости (2) в проводниках (а), полупроводниках (б) и диэлектриках (в)
Рис. 27. Энергетические зоны в кри-сталле натрия

Энергетические 1s-, 2s- и 2р-зоны заполнены 1s22s22p6-электронами каждого атома натрия, 3s-зона — валентными 3s1-электронами, а 3p-зона остается вакантной.
Зона, в которой находятся валентные электроны, называется валентной, а вакантная зона (находящаяся над валентной зоной) — зоной проводимости. В кристалле натрия валентной зоной является 3s-зона, а зоной проводимости — 3p-зона.
В соответствии с зонной теорией электрическая проводимость кристалла обусловлена тем, что, во-первых, в пределах неполностью занятой валентной зоны имеется много свободных энергетических состояний, между которыми возможна миграция валентных электронов, и, во-вторых, валентные электроны способны покидать валентную зону и переходить в зону проводимости.
Переход электронов из валентной зоны в зону проводимости протекает почти без затруднений, если эти зоны перекрываются (рис. 28, а). Такое расположение зон характерно для металлов, которым благодаря этому свойственна электронная проводимость. Поэтому металлы относят к проводникам. Если же между валентной зоной и зоной проводимости имеется очень большой энергетический зазор (рис. 28в), называемый в рамках квантово-механических терминов запрещенной зоной, то переход электронов невозможен, и данные вещества будут относиться к диэлектрикам (изоляторам). Обычно диэлектриками являются ковалентные соединения, ионные кристаллы и алмазоподобные неметаллические простые вещества, например трииодид фосфора РI3, NаС1 и сам алмаз, в отличие от которого графит — проводник.
|
|
|

Рис. 29. Изображение кристалла кремния с примусным атомом фосфора (а, полупроводник n-типа) или бора (б, полупроводник p-типа). — избыточный электрон; + положительная «дырка»
Наконец, при наличии малого энергетического зазора (рис. 28б) валентные электроны, приобретающие под внешним воздействием, например, теплового, светового облучения дополнительную, оказываются способными преодолевать запрещенную зону (происходит перескок валентных электронов в зону проводимости), В результате повышается электронная проводимость вещества, что используется в технике (например, в фотодиодах). Вещества, электронное строение которых характеризуется узкими запрещенными энергетическими зонами, называются полупроводниками. К ним относятся, в первую очередь, кремний, германий, селен и теллур, а также некоторые соединения, например GаАs, InF, ZnТе.
Электронную проводимость можно создать или увеличить искусственным путем — введением примесмых атомов других элементов в основное вещество. Этот процесс называется легированием полупроводника. Например, полупроводниковые свойства кремния (атом которого имеет 4 валентных электрона) можно улучшить введением в кристалл примесных атомов бора (3 валентных электрона) или фосфора (5 валентных электронов). Каждый атом Р вводит в кристаллическую решетку кремния один избыточный валентный электрон, а каждый атом В как бы выводит один электрон. Недостаток одного электрона соответствует так называемой положительно заряженной «дырке». Это показано на рис. 29. «Дырки» ведут себя так, как если бы на их месте находились электроны, но положительно заряженные. Атомы фосфора обеспечивают дополнительную электронную проводимость, и в результате образуется полупроводник n-типа, атомы бора создают дырочную проводимость, характерную для полупроводника p-типа.
|
|
|
Избыточные электроны (например, за счет введения атомов фосфора) находятся на энергетическом уровне, который лежит несколько ниже зоны проводимости основного вещества (например, кремния) и называется донорным уровнем примеси (рис. 30 а). Ввиду малой ширины запрещенной зоны между донорным уровнем и зоной проводимости примесные электроны легко переходят в последнюю и улучшают свойства полупроводника n-типа.
При недостатке электронов, вызванном примесными атомами (например, бора), т. е. при возникновении положительных «дырок», образуется акцепторный уровень примеси (рис. 30,6). Этот уровень располагается несколько выше уровня валентной зоны основного вещества (например, кремния). Электроны основного вещества легко переходят на акцепторный уровень, а в валентной зове появляются дополнительные положительные «дырки», которые заполняются другими электронами. Такое встречное движение «дырок» а электронов создает электрический ток в полупроводнике p-типа.
Путем легирования можно получать полупроводннки с эаранее задан-ными свойствами. Полупроводники широко применяются в электронных при-борах, с помощью которых преобраэуется к передается ииформация (ЭВМ, лазеры, фото- и термоэлектронные датчики и др.).
Химическую связь (в дальнейшем – связь) можно определить как взаимодействие двух или нескольких атомов, в результате которого образуется химически устойчивая многоатомная микросистема (молекула, кристалл, комплекс и др.).
Учение о связи занимает центральное место в современной химии, поскольку химия как таковая начинается там, где кончается изолированный атом и начинается молекула. В сущности, все свойства веществ обусловлены особенностями связей в них. Главное отличие химической связи от других видов взаимодействия между атомами заключается в том, что ее образование определяется изменением состояния электронов в молекуле по сравнению с исходными атомами.
Теория связи должна дать ответы на ряд вопросов. Почему образуются молекулы? Почему одни атомы вступают во взаимодействие, а другие – нет? Почему атомы соединяются в определенных соотношениях? Почему атомы располагаются в пространстве определенным образом?
|
|
|
Квантовая механика позволяет описать связь, исходя из самых общих законов. Хотя различают пять видов связи (ковалентная, ионная, металлическая, водородная и связь межмолекулярного взаимодействия), связь едина по своей природе, а различия между ее видами – относительны. Суть связи в кулоновском взаимодействии, в единстве противоположностей – притяжения и отталкивания. Деление связи на виды и различие в методах ее описания указывает скорее не на разнообразие связи, а на недостаточность знаний о ней на современном этапе развития науки.
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 310; Нарушение авторских прав?; Мы поможем в написании вашей работы!