
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Потенциометрия и потенциометрическое титрование
|
|
|
|
Электрохимические методы анализа, их классификация, сущность
Задача 2
Задача 1
Теоретические основы спектральных (оптических) методов анализа, их классификация
Классификация физико-химических методов
В зависимости от измеряемых характеристик различают следующие группы физико-химических методов:
1. Оптические (спектральные), основанные на измерении оптических свойств анализируемых систем (на взаимодействии веществ с электромагнитным полем). Они позволяют определять структуру, геометрию и полярность молекул, длины связей, а также количество вещества по интенсивности полос в спектре.
2. Электрохимические, основанные на измерении электрохимических свойств. Позволяют проводить анализ растворов электролитов.
3. Физико-химические методы разделения и концентрирования (хроматография, ионный обмен, диализ, электрофорез).
4. Радиометрические, основанные на измерении радиоактивности исследуемых объектов.
5. Масс-спектрометрические, основанные на ионизации атомов и молекул изучаемого вещества с последующим разделением образующихся ионов в пространстве и определения их масс. Позволяют определять состав и строение молекул, энергию тонизации, а также характеристики обратимых процессов.
Физико-химические методы анализа имеют следующие достоинства:
1) селективность: некоторые методы позволяют одновременно определять десятки компонентов, входящих в состав исследуемой системы;
2) экспрессность - высокая скорость выполнения анализа;
3) предел обнаружения ниже, чем у химических методов. Физико-химическими методами можно проводить анализ при содержании компонента 10-4 – 10-5 % масс, химическими методами – 10-1 – 10-2 % масс;
|
|
|
4) физико-химические методы дают возможность работать с ненарушенными образцами, поэтому они нашли широкое применение в биологии и медицине.
К оптическим (спектральным) методам анализа относятся методы, основанные на взаимодействии электромагнитного излучения с веществом.
Это взаимодействие приводит к различным энергетическим переходам, которые регистрируются экспериментально в виде поглощения, излучения, отражения и рассеяния электромагнитного излучения.
Отражение света

Рассеяние света
Поглощение света

Люминесценция
Рис. 1 Общая картина взаимодействия электромагнитного излучения с веществом
Электромагнитное излучение может быть охарактеризовано следующими параметрами:
– длина волны (λ) – расстояние между двумя максимумами волны, м, нм, мкм.
λ 1 нм = 10‾9 м

 1 мкм = 10‾6 м
1 мкм = 10‾6 м
– частота (ν) – число колебаний в 1 секунду, с‾1 или Гц.

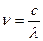 (2)
(2)
где с – скорость света в вакууме (2,9979∙108 м/с).
 – волновое число (
– волновое число (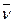 ) – число длин волн, приходящихся на 1 см пути излучения в вакууме, см‾1.
) – число длин волн, приходящихся на 1 см пути излучения в вакууме, см‾1.
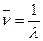 (3)
(3)
– энергия излучения (Е), Дж или эВ.
Е = hν, (4)
где h – постоянная Планка (6,626∙10‾34 Дж∙с).
Важнейшей характеристикой электромагнитного излучения является его спектр, т.е. совокупность различных значений, которые может принимать данная физическая величина. Совокупность всех частот или длин волн электромагнитного излучения называется электромагнитным спектром.
Интервал длин волн от 10‾10 до 10‾1 м разбивают на области:
УФ види- ИК
мая
 |  |  | |||



 Рентгеновское
Рентгеновское
излучение


 Радиоволны
Радиоволны
 |  |  |  | |||||||||
 | ||||||||||||
 |  | |||||||||||
λ, нм 10 102 103 104 105 106
Рис. 2. Области электромагнитного спектра
|
|
|
Ультрафиолетовая область (УФ) охватывает диапазон 10-380 нм, инфракрасная область (ИК) – 750-1·105 нм, видимый свет занимает узкую область – 380-750 нм.
КЛАССИФИКАЦИЯ МЕТОДОВ ОПТИЧЕСКОГО АНАЛИЗА
1. Методы, основанные на поглощении веществом светового потока. К ним относятся фотоколориметрия и спектрофотометрия.
2. Методы, основанные на излучении веществом электромагнитных волн. К ним относятся фотометрия пламени, атомно-флуоресцентный анализ и др.
Фотометрический анализ (молекулярная абсорционная спектроскопия) основан на способности вещества поглощать электромагнитные излучения оптического диапазона. В основе фотометрического анализа лежит избирательное поглощение света частицами (молекулами и ионами) вещества в растворе. При некоторых длинах волн свет поглощается интенсивно, а при некоторых – не поглощается совсем.
Методы фотометрического анализа
 |  |
фотоколориметрия спектрофотометрия
анализ на основе измерения анализ на основе измерения
поглощения излучения видимой поглощения УФ, видимой и
области спектра ИК областей спектра
Прибор: Прибор: спектрофотометр
фотоэлектроколориметр (ФЭК)
Фотоколориметрические методы широко распространены в работе клинических лабораторий для количественного определения йода, азота, мочевой кислоты в моче, билирубина и холестерина в крови и желчи, гемоглобина в крови и т.д. В санитарно-гигиеническом анализе колориметрия применяется для определения аммиака, фтора, нитратов и нитритов, солей железа, витаминов и других веществ.
Фотоколориметрический метод анализа основан на сравнении интенсивности окраски исследуемого раствора с окраской раствора, концентрация которого неизвестна. Раствор с известной концентрацией называется стандартным или образцовым раствором.
Этим методом можно анализировать лишь окрашенные растворы. Если раствор бесцветный, то в него добавляют реагент, образующий окрашенное соединение с исследуемым веществом (фотометрическая реакция).
исслед. в-во + реагент ↔ окраш. соед.
Cu2+ + 4NH3 ↔ [Cu(NH3)4]2+
Fe3+ +6CN- ↔ [ Fe(CN)6]3-
В основе фотоколориметрического анализа лежит закон светопоглощения Бугера-Ламберта-Бера: при прохождении светового потока через поглощающий раствор интенсивность прошедшего светового потока (I) отличается от интенсивности падающего светового потока (Io) на поглощение света раствором.
|
|
|
  
 I I
|
I0 I
 |
b (толщина кюветы)
Рис. 3. Прохождение светового потока через поглощающую среду
Отношение I/Io называется пропусканием раствора и обозначается Т.
 (5)
(5)
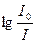 – важная характеристика раствора, называется оптической плотностью D:
– важная характеристика раствора, называется оптической плотностью D:
 (6)
(6)
Обычно Т выражают в %:
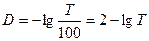 (7)
(7)
Уменьшение интенсивности света при прохождении через поглощающий раствор подчиняется закону Бугера-Ламберта-Бера:
I = I0 · 10‾cb или D = ε bc, (8)
где ε – молярный коэффициент поглощения, являющийся основной характеристикой поглощения света системой при данной длине волны.
Причины отклонения от закона:
1) изменение степени диссоциации при разбавлении;
2) изменение степени гидратации ионов;
3) присутствие посторонних электролитов
Важным дополнением к закону Б-Л-Б является закон аддитивности светопоглощения. Если в растворе присутствует несколько поглощающих веществ, то оптическая плотность раствора равна сумме вкладов каждого из компонентов:
Д=Д1+Д2+Д3
Важным этапом фотометрического анализа раствора является выявление длины волны светового потока, соответствующей максимальному светопоглощению. Для этого измеряют Д раствора при разных λ и строят график Д=Д(λ). Работа в области максимума поглощения обеспечит наибольшую чувствительность и точность определения.
Чтобы обеспечить максимальное поглощение в ФЭКе есть набор светофильтров. Светофильтры – это специальные стёкла, поглощающие излучение определённых длин волн.
Навеску массой 0,0162 г n-нитроанилина NH2C6H4NO2 растворили в мерной колбе вместимостью 50,00 см3. Полученный раствор разбавили в 100 раз. Оптическая плотность разбавленного раствора D = 0,40 (λ =368 нм, b = 10 мм). Вычислите молярный коэффициент светопоглощения n-нитроанилина.
|
|
|
Решение:
Молярный коэффициент светопоглощения (ε) вычисляют по основному закону светопоглощения:
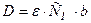
где СМ – молярная концентрация поглощающего вещества, моль/дм3
b – толщина светопоглощающего слоя, см
Откуда 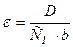
Находят молярную концентрацию n-нитроанилина в исходном растворе:

После разбавления раствора концентрация n-нитроанилина уменьшится в 100 раз (2,35∙10‾5 моль/дм3):
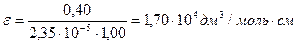
Ответ: ε = 1,70∙104 дм3/моль∙см
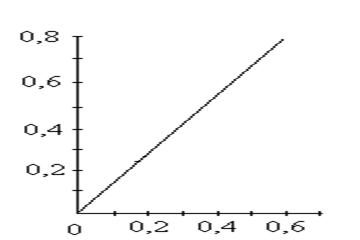
В 6 мерных колб вместимостью 100,0 см3 поместили 1,00; 2,00; 3,00; 4,00; 5,00 и 6,00 см3 стандартного раствора Fe3+ с концентрацией 10,0 мг/см3. После проведения реакции с сульфосалициловой кислотой оптические плотности растворов соответственно равны: 0,12; 0,25; 0,37; 0,50; 0,62 и 0,75. Оптические плотности анализируемых растворов 0,30 и 0,50. Вычислить концентрацию Fe3+ в этих растворах.
Решение:
Рассчитывают концентрации (мг/см3) Fe3+ в стандартных растворах:

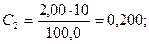



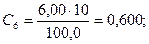
Градуировочный график линеен, выходит из начала координат:
D
 См(Fe3+), мг/см3
См(Fe3+), мг/см3
Для расчета концентрации Fe3+ в анализируемых растворах применяют соотношение:

где СХ и Сст. – концентрации определяемого вещества в анализируемом и стандартном растворах;
DХ и Dст. – оптические плотности растворов.

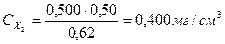
Ответ: 0,240 мг/см3
0,400 мг/см3
Существуют различные методы фотоколориметрического определения вещества в растворе:
 1. Метод калибровочного (градуировочного) графика. Готовят серию из 5-8 стандартных растворов разных концентраций, измеряют их оптическую плотность, строят график в координатах Д–С. Затем измеряют поглощение анализируемого раствора и по графику определяют его концентрацию (см. рис. 4).
1. Метод калибровочного (градуировочного) графика. Готовят серию из 5-8 стандартных растворов разных концентраций, измеряют их оптическую плотность, строят график в координатах Д–С. Затем измеряют поглощение анализируемого раствора и по графику определяют его концентрацию (см. рис. 4).
D
 0,6
0,6
,3
 0,2
0,2
 0,1
0,1

10 20 30 40 50 С (Fe3+), мкг/мл
Рис. 4 График зависимости оптического поглощения от концентрации
2. Метод добавок. К анализируемому раствору добавляют точную навеску вещества. Измерив оптическую плотность раствора с добавкой (D) и без добавки (D0), рассчитывают концентрацию анализируемого раствора (С0):
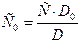 (9)
(9)
3. Метод стандартных растворов. Оптическую плотность исследуемого раствора (DX) сравнивают с оптической плотность стандартного раствора (Dст.) этого же вещества. Неизвестную концентрацию исследуемого раствора (СХ) рассчитывают по формуле:
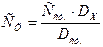 (10)
(10)
где Сст. – концентрация стандартного раствора, моль/л.
оптической плотности раствора в процессе титрования. Аликвотный объём анализируемого раствора помещают в кювету, через которую проходит свет с определённой длиной волны λ. В кювету постепенно добавляют титрант и измеряют Д.
Электрохимическими называются процессы, протекающие в растворе под воздействием электрического тока, либо процессы, протекание которых сопровождается возникновением электрического тока во внешней цепи.
Электрохимические методы анализа основаны на использовании электрохимических процессов, происходящих в электролитической ячейке. Электролитическая ячейка состоит из электродов, опущенных в раствор электролита

Рис 5
Различают два типа электролитических ячеек:
1) гальванический элемент,в котором энергия химических реакций преобразуется в энергию электрического тока


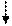 (–) Zn / Zn2+ // Cu2+ / Cu (+)
(–) Zn / Zn2+ // Cu2+ / Cu (+)
ОВП диффу- ОВП
зионный
потенциал
Е = φкат – φанод
2) электролитическая ячейка, в которой химическая реакция протекает под воздействием внешнего электрического поля (работает как электролизёр).
эл. ток
 Cu2+ + H2O Cu + ½ O2 + 2 H+
Cu2+ + H2O Cu + ½ O2 + 2 H+
В состав электролитической ячейки могут входить 2 и более электрода. Из двух электродов один является измерительным (индикаторным), а второй – вспомогательным (электродом сравнения).
Большинство электрохимических процессов являются окислительно-восстановительными.
Схема ОВР: Ок1 + Вос2 ⇄Ок2 + Вос1
Ок1/Вос1 и Ок2/Вос2 – сопряженные пары.
Если ОВР протекает в водном растворе, то характеристикой каждой сопряженной пары является ее окислительно-восстановительный потенциал (ОВП), φок/вос, В. Чем меньше ОВП, тем сильнее восстановитель и слабее сопряженный с ним окислитель.
Сила окислителей и восстановителей зависит от:
• их природы,
• концентрации,
• температуры,
• иногда от рН.
Влияние температуры и концентрации на ОВ свойства веществ описывается уравнением Нернста (1889):

где n – число отданных или принятых электронов,
F – число Фарадея, равное 96500 Кл/моль,
тогда 
Характеристикой ОВР является ее электродвижущая сила (ЭДС) Е, В:
Е = φОк1/Вос1 – φОк2/Вос2
Если Е > 0, то ΔrG < 0 – реакция протекает самопроизвольно;
Если E < 0, то ΔrG > 0 – реакция протекает несамопроизвольно.
Большинство ОВР имеют обратимый характер, поэтому их важной характеристикой является константа равновесия (К):
ΔrG0 = – RTlnK ΔrG0 = – nFE0 nFE0 = RTlnK
отсюда 
Пример:
Вычислить ОВ-потенциал медного электрода, помещенного в 0,01 M раствор CuSO4 относительно насыщенного хлорсеребряного электрода и ЭДС.
Решение: Медный электрод, помещенный в раствор меди сульфата, является электродом I рода, его ОВ-потенциал φ зависит от природы потенциалопределяющей редокс-пары и концентрации Cu2+:
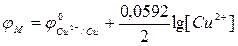
 (из таблицы)
(из таблицы)
Вводят численные значения величин
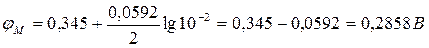
Потенциал одного электрода относительно другого представляет собой разность потенциалов электродов, измеренных относительно стандартного водородного электрода. Потенциал насыщенного хлорсеребряного электрода φХС = 0,201 В (из таблицы). Электродвижущая сила элемента, составленного из медного и насыщенного хлорсеребряного электродов:
Е = φМ – φХС = 0,2858 – 0,201 = 0,0848 В
Ответ: Е = 0,0848 В
В зависимости от типа электролитической ячейки электрохимические методы можно разделить на несколько групп:
1. Потенциометрия и потенциометрическое титрование (ячейки 1 типа).
2. Вольтамперометрия, полярография, кулонометрия, электрогравиметрия (ячейки 2 типа).
3. Кондуктометрия и кондуктометрическое титрование.
Полярография, кулонометрия, электрогравиметрия и др. методы основаны на использовании ячеек 2 типа. В основе этих методов лежат законы Фарадея для электролиза:

где m – масса выделенного на электроде вещества, г
I – сила тока, А
τ – время, сек.
F – постоянная Фарадея
Электрогравиметрический анализ основан на выделении из растворов электролитов веществ, осаждающихся на электродах при прохождении через раствор постоянного электрического тока. Выделившийся при электролизе металл взвешивают и по его массе рассчитывают содержание вещества в растворе.
Например:
К (–): Cu2+ + 2 ē → Cu0
A (+): 2H2O – 4 ē → O2 + 4 H+
Кулонометрический анализ позволяет определять концентрацию вещества в растворе путем измерения количества электричества, необходимого для полного превращения вещества в ходе его электролитического восстановления (окисления). Легко поддающиеся измерению величины и относительная простота аппаратуры делают этот метод одним из удобных для применения в практике аналитических лабораторий.
Полярография основана на измерении силы тока, изменяющегося в зависимости от напряжения в процессе электролиза, в условиях, когда один из электродов имеет очень малую поверхность. Обычно таким электродом являются капли ртути, вытекающие из капиллярного отверстия трубки.

Рис 3. Полярографическая волна
Е0,5 – потенциал полуволны, он характеризует природу восстанавливаемых ионов и не зависит от концентрации. По величине Е0,5 можно определить присутствующий ион. По величине h – концентрацию.

где СХ и hX – характеристики стандартного раствора.
Таким образом, полярография является одновременно методом и качественного и количественного анализа. Данный метод позволяет анализировать смесь катионов в растворе
I, А
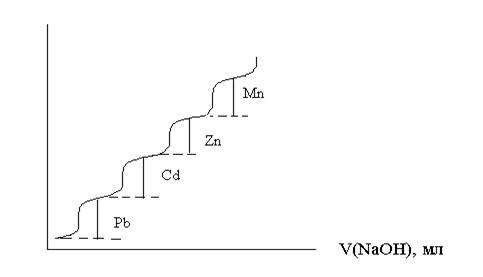
Рис 4. Полярограмма раствора, содержащего смесь катионов
Кондуктометрия основана на измерении электропроводности анализируемых металлов, изменяющейся в результате химических реакций. В основе метода лежит закон Ома: сопротивление раствора прямо пропорционально расстоянию между электродами и обратно пропорционально площади их поверхности.

где R – электрическое сопротивление, Ом
ρ – удельное сопротивление, Ом·см
d – расстояние между электродами, см
А – площадь поверхности, см2
Величину, обратную удельному сопротивлению, называют удельной электропроводностью (Ом‾1):
ӕ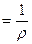
Широко применяется кондуктометрическое титрование:
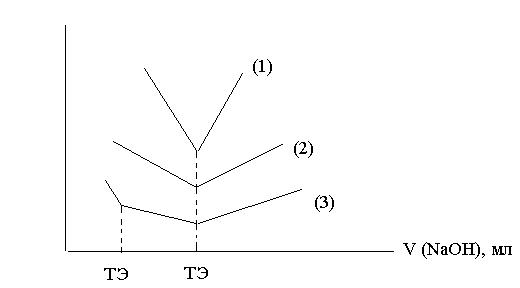
Рис. 5
NaOH + HCl → NaCl + H2O (1)
CH3COOH + NaOH → CH3COONa + H2O (2)
смесь сильной и слабой кислот (3)
Потенциометрия – это совокупность электрохимических методов анализа растворов, основанных на измерении ЭДС специально составленных ГЭ. Потенциометрические методы позволяют определить активность (концентрацию) ионов в растворах электролитов, т.к. активность (а) и ЭДС (Е) связаны между собой уравнением Нернста:

Развитие современных методов потенциометрического анализа идёт по нескольким направлениям:
Потенциометрия
 |  |  | |||
Редоксиметрия потенциометрическое
титрование
ионометрия
 |  |  | |||
рН-метрия катионометрия анионометрия
Этот метод позволяет вести измерения в мутных и окрашенных растворах, пастах и даже живых биологических объектах. Можно исследовать многокомпонентные смеси веществ без предварительного их концентрирования. Точность определения – 0,1%.
Типы электродов, применяемых в потенциометрии:
Электроды 1-го рода – металл, опущенный в раствор своей соли:
Cu / Cu2+aq; Zn / Zn2+aq
Электроды 2-го рода – металл, покрытый слоем своего труднорастворимого соединения и опущенный в раствор соли
При потенциометрических исследованиях используются следующие электроды:
1. Окислительно-восстановительные
Ох + nē ⇄Red

2. Электроды ионоселективные (мембранные). Они состоят из мембраны, внутреннего раствора и внутреннего электрода сравнения (чаще всего хлорсеребряного (Рис. 6).
Ag, AgCl / HCl / ст.мембрана
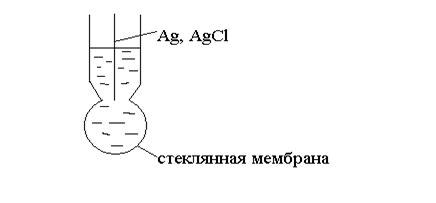
Рис. 6
Мембранный потенциал возникает вследствие неравномерного распределения ионов во внешнем и внутреннем растворе.

Например, стеклянный электрод с водородной функцией, применяемый для измерения рН растворов.
ИСЭ могут иметь стеклянную мембрану (служат для определения рН), твердокристаллическую мембрану (для определения показателя галогенов рCl, pF, pI) и жидкостную мембрану (для определения pCa, pMg).
Селективность электродов, т.е. возможность определения того или иного иона в присутствии мешающих ионов, колеблется в очень широких пределах. Для количественной оценки влияния мешающих ионов введён коэффициент селективности К. Если К<1, то электрод избирателен по отношению к определяемому иону в присутствии мешающего. Если К=1, электрод одинаково чувствителен к обоим ионам. Если К>1, то электрод более чувствителен к мешающему иону. К определяют экспериментально.
Существуют различные способы устранения нежелательного влияния мешающих ионов. Например, мешающее действие ионов Br‾. CN‾, S2‾ на работу хлорсеребряного электрода устраняют добавлением окислителей.
Сферу применения ИСЭ можно расширить при помощи второй мембраны. Например, для серийных измерений парциального давления СО2 в плазме крови применяют стеклянный электрод, покрытый тонкой плёнкой тефлона или другого газопроницаемого материала. Между плёнкой и стеклом находится слой 0,1М раствора NaHCO3. СО2 диффундирует через плёнку полимера в соответствии со своим давлением, вызывая изменение рН раствора NaHCO3, что и фиксирует стеклянный электрод.
3. Электроды второго рода
а) хлорсеребряный Ag, AgCl / KClнас.
AgCl + ē → Ag + Cl‾
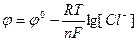
б) каломельный Hg, Hg2Cl2 / KCl
Hg2Cl2 + 2 ē → 2 Hg + 2 Cl‾

На рис 7. приведена принципиальная схема устройства, применяемого для измерения электродвижущей силы или рН анализируемого раствора.
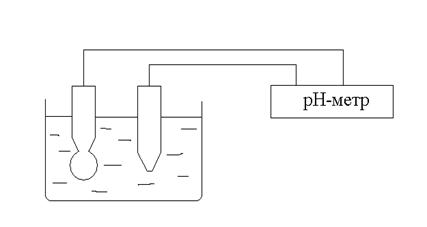
Рис. 7
Ионометрия – это метод прямой потенциометрии, позволяющей определять активность иона в растворе при помощи ИСЭ.
Потенциометрическое титрование – косвенная потенциометрия – основано на фиксировании точки эквивалентности по резкому изменению потенциала электрода, реагирующего на изменение активности того или иного компонента или продукта реакции.
Потенциометрическое титрование выполняют следующим образом:
В титруемый раствор помещают индикаторный электрод и электрод сравнения, после чего из бюретки небольшими порциями добавляют титрант.
Если при титровании протекает кислотно-основное взаимодействие, то составляют ГЭ из стеклянного электрода и хлорсеребряного.
Если протекает ОВР, то из платинового электрода и хлорсеребряного.
Потенциометрическое определение рН растворов
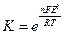 ГЭ элемент состоит из стеклянного электрода (измерительного) и хлорсеребряного электрода (вспомогательного).
ГЭ элемент состоит из стеклянного электрода (измерительного) и хлорсеребряного электрода (вспомогательного).
Схема ГЭ для определения рН
Ag, AgCl / HCl / ст.мембрана / Иссл. р-р // KClнас. /AgCl, Ag
Стеклянный электрод Хлорсеребряный
электрод
Е = Е0 + 0,059 рН
Метод отличает быстрота и точность выполнения.
Потенциометрическое титрование – это любой метод титриметрического анализа, в котором точка эквивалентности фиксируется по резкому изменению ЭДС гальванического элемента, опущенного в исследуемый раствор.
Потенциометрические методы анализа позволяют:
· анализировать окрашенные растворы, растворы с осадком и гели,
· получать точные результаты в короткое время (экспресс-анализ),
·
Приемы нахождения точки эквивалентности
Е, мВ 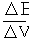



 V, мл
V, мл
ТЭ ТЭ
а) зависимость Е от V титранта б) зависимость первой производной
ΔЕ/ΔV от V титранта






V, мл
ТЭ
в) зависимость ΔV/ΔE от V титранта
Рис. 8. Приемы нахождения точки эквивалентности
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 906; Нарушение авторских прав?; Мы поможем в написании вашей работы!

