
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вода как протонный растворитель
Кислоты и основания проявляют свои свойства во взаимодействии. В растворах роль второго партнера играет растворитель. В качестве протонного растворителя особенно важна вода. Она играет роль основания по отношению к кислотам, и роль кислоты по отношению к основаниям.
При выводе констант равновесия понадобится знать концентрацию воды. Она в разбавленных водных растворах может считаться постоянной, благодаря большому избытку воды, и равной
с(Н2О) = 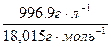 = 55,3 моль/л
= 55,3 моль/л
В воде устанавливается равновесие аутоионизации при концентрациях ионов с(Н3О+) = с(ОН-) = 1×10–7 моль/л.
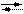 Н2О + Н2О Н3О+ + ОН- или упрощенно
Н2О + Н2О Н3О+ + ОН- или упрощенно
 Н2О Н+ + ОН-.
Н2О Н+ + ОН-.

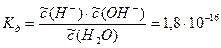 (пояснение: 3,2·10–18×55,3 = 1,8×10–16)
(пояснение: 3,2·10–18×55,3 = 1,8×10–16)
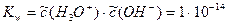 (298,15°С) (пояснение: 1,8×10–16 ×55,3 = 1×10–14)
(298,15°С) (пояснение: 1,8×10–16 ×55,3 = 1×10–14)
Последняя константа, называемая ионным произведением воды, используется наиболее часто. Приходится учитывать зависимость Kw от температуры:
| Норм условия | Станд условия | Физиолог условия | |
| T | 273,15 К (0°С) | 298,15 К (25°С) | 310,15 К (37°С) |
| Kw | 1,1×10–15 | 1×10–14 | 2,4×10–14 |
| pKw | 14,96 | 13,62 |
Ионизацией воды обусловлено присутствие ионов гидроксония (ионов водорода, как говорят упрощенно) в водных растворах веществ любых классов, включая основания. Кислоты и основания смещают равновесие ионизации. В растворах кислот низка концентрация ОН–, в растворах оснований – низка концентрация Н3О+, но оба вида ионов всегда присутствуют одновременно, причем произведение их концентраций постоянно. Всякий раствор можно охарактеризовать как водородным показателем рН = –lg с (Н+), так и гидроксидным показателем рОН = = –lg с (ОН–).
рН + рОН = 14
Практически широко применяется только водородный показатель рН.
Вода хороший ионизирующий растворитель. Молекула воды легко связывает протон, но может и отдавать свой протон. Азотная кислота в вводом растворе ведет себя как сильная, а в уксусной кислоте – слабая.
|
|
Дата добавления: 2013-12-13; Просмотров: 424; Нарушение авторских прав?; Мы поможем в написании вашей работы!