
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Биогенные р-элементы
|
|
|
|
Аномальная вязкость полимеров. Течение начинается лишь при приложении определенного напряжения, после чего вязкость падает. Это связано со структурированием в растворе. Скорость деформации начинает расти лишь после приложения определенного напряжения.


Рис. 9. Аномальная вязкость растворов ВМС
Уравнение Эйнштейна h = hо(1 + 2,5Ф), где Ф – объемная доля молекул полимера:
h/hо - 1 = hудельн = 2,5Ф
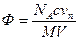 ; с в г/л; v n – гидродинамический объем
; с в г/л; v n – гидродинамический объем
Марк – Кун – Хаувинк hудельн = K × M × c г/л
Уравнение Штаудингера [h] = K × M a; a зависит от формы макромолекулы.: для глобул белков a = 0,5; беспорядочные клубки – a = 2.
Роль химических элементов металлов и неметаллов в химии жизни принципиально различна. Из неметаллов строится тело живых организмов, а при участии металлов осуществляются физиологические процессы жизнедеятельности. Элементы, образующие белки, полинуклеотиды, углеводы и жиры называются органогены. Они принадлежат к р -блоку химических элементов, и находятся в верхнем правом углу таблицы Менделеева. К органогенам следует отнести и s -элемент водород, отличающийся от металлов групп IA и IIA ковалентным характером химических связей.

Биогенные р -элементы в таблице Менделеева
(даны значения массы (г) на 70 кг массы человека)
Следует помнить, что у элементов р -блока электронами заполняется внешний р -подуровень. Емкость р -подуровня 6 электронов, чем обусловлено наличие в таблице Менделеева шести групп р -элементов с IIIA по VIIIA.
Элементы группы IIIA. Один электрон на внешнем р -подуровне имеют элементы группы IIIA – бор, алюминий, галлий, индий и таллий. Эти элементы называют электроннодефицитными, так как на 4 валентных орбитали (s +3 p) у них имеется только 3 электрона. Они проявляют акцепторные свойства. Например, фторид бора присоединяет ион F–, образуя комплексное соединение:
|
|
|
BF3 + F– = [BF4]–
Борная кислота B(OH)3 не отдает протон молекуле воды, как другие кислоты, а связывает гидроксид-ион:
 B(OH)3 + 2H2O [B(OH)4]– + H3O+
B(OH)3 + 2H2O [B(OH)4]– + H3O+
Действие борной кислоты как мягкого антисептического средства объясняется ее способностью присоединяться к гидроксо-группам, расположенным рядом у атомов углерода в биомолекулах:





 СН2–СН–СН2 +В(ОН)3 = СН2–СН–СН2 + H3O+
СН2–СН–СН2 +В(ОН)3 = СН2–СН–СН2 + H3O+

 ОН ОН ОН ОН О О
ОН ОН ОН ОН О О

 В–
В–
НО ОН
Гидроксид алюминия, аналога бора, также проявляет слабые кислотные свойства, связывая гидроксид-ион:
Al(OH)3 + OH– = [Al(OH)4]–
Биологическая необходимость бора и алюминия не ясна. Бор в микроколичествах ускоряет рост растений. Алюминий, так же как и другие элементы, обнаружен в организме человека. Его проникновение обусловлено высоким содержанием в окружающей среде. Масса алюминия в теле человека около 0,06 г. Значительная доля этой массы находится в легких, подкожных тканях и скелете. Окончательных выводов о биогенности алюминия пока нет.
Последний элемент группы таллий характеризуется устойчивостью степени окисления +1 и сильной ядовитостью, так как образует прочные связи с серой белков. Первым проявлением токсического действия таллия является выпадение волос.
Элементы группы IVA. Группа IVA начинается с углерода, структурообразующего элемента всех биоорганических молекул. Перечислим главные характеристики атома углерода, которые определяют его биологическую роль. Углерод всегда образует 4 ковалентные связи. При этом у него не остается ни свободных валентных орбиталей, ни неподеленных электронных пар. Следовательно, увеличение числа связей невозможно. Атом углерода может находиться в трех гибридных состояниях с разной пространственной направленностью связей. Высокой прочностью отличаются связи между самими атомами углерода, причем прочность образующихся углеродных структур не уменьшается при увеличении числа атомов. Всем этим обеспечивается разнообразие молекул как по составу, так и по пространственному строению.
|
|
|
В биоорганических молекулах углерод бывает связан с другими атомами углерода, водородом, кислородом, азотом и серой. Связи с атомами других элементов встречаются редко, но и они могут играть важную роль. В гормонах щитовидной железы имеются связи углерода с иодом, а в реакциях переноса метила при участии кобаламина образуется связь углерода с кобальтом. Атом углерода может образовать связи одновременно с тремя, а иногда и с четырьмя разными атомами. У других элементов подобные сочетания связей встречаются редко.
На атоме углерода могут идти реакции замещения отдельных атомов или атомных групп при сохранении остальных имеющихся связей. Это открывает возможность целенаправленного изменения молекул.
Реакции замещения на атомах углерода могут быть одновременно реакциями окисления-восстановления. По электроотрицательности атом углерода (χ =2,5) находится между водородом (χ =2,1) с одной стороны и кислородом, азотом, галогенами, с другой стороны. Например, замещение водорода на хлор в метане является одновременно окислением углерода, а последующее замещение хлора на гидроксо-группу – не является окислением-восстановлением.
Химические связи атомов углерода не только устойчивы, но и инертны. Это означает, что термодинамически возможные реакции протекают медленно. В этом важнейшее условие формирования молекулярных и надмолекулярных структур, способных не только длительное время существовать, но и участвовать в процессах обмена, накопления массы и т. д. Медленные процессы изменения молекул могут при необходимости ускоряться катализаторами, которые тоже являются соединениями углерода.
Таким образом, важнейшая функция углерода структурная. Очень важна также энергетическая функция углерода, так как источником энергии для клеток служит окисление органических соединений по связям С–С и С–Н. Биологическое окисление органических соединений происходит по тонко отлаженным механизмам. Следует обратить внимание на то, что оксид углерода(IV) образуется не в результате взаимодействия молекулы кислорода с молекулой органического вещества, а в результате дерарбоксилирования кетокислот:
|
|
|
НООССОСН2СН2СООН+Н2О =
= СО2+НООССН2СН2СООН+2Н
α-кетоглутаровая кислота янтарная кислота
Водород сразу же идет на восстановление NAD, и далее по дыхательной цепи электроны передаются на восстановление кислорода. Вот это высокая технология!
В жизнедеятельности важную роль играют также неорганические соединения углерода СО2, NaHCO3 (НСО3–), СО(NH2)2. Растворенный углекислый газ не только конечный продукт окисления, но и компонент одной из буферных систем крови вместе с гидрокарбонатом натрия. Мочевина является конечным продуктом метаболизма азотсодержащих веществ.
Аналог углерода кремний, второй по распространенности элемент земной коры, похож на углерод лишь по электронной структуре атома. Среди химических соединений сходство обнаруживается только в пространственном строении алканов и кремневодородов (силанов). О биологической необходимости кремния для человека сведения противоречивы. Есть данные, что кремний нужен на начальном этапе формирования костной ткани. О содержании кремния в теле человека данные не надежны: от 0,14 г до 18 г! (Handbook of chtmistry and physics, 2005). При содержании 18 г кремний переходит в разряд макроэлементов.
Элементы группы VA. В группе VA находятся биогенные макроэлементы азот и фосфор. Нет окончательного вывода о биологической значимости мышьяка. Хорошо известно лишь то, что уже в набольших дозах его соединения сильно ядовиты.

По сравнению с атомом углерода, атом азота имеет на один электрон больше, и на его валентной оболочке возникает электронная пара. Сравнивая атомы бора, углерода и азота (см. рис.), углерод можно назвать сбалансированным по электронам. У него одинаковое число как валентных орбиталей (4), так и валентных электронов. Такой атом четырехвалентен. У находящегося слева бора недостает одного электрона, остается свободная орбиталь 2 р. Он трехвалентен, но может образовать четвертую связь как акцептор электронной пары. Таким образом, бор является кислотой Льюиса. Атом азота, в противоположность бору, имеет избыток в один электрон. Как и бор, азот трехвалентен, но легко образует четвертую связь в качестве донора электронной пары. Это означает проявление основных свойств. Основность атома азота оказывается несопоставимо более важной, чем кислотность атома бора. Биологическая необходимость азота связана с его основными свойствами.
|
|
|
Добавление электрона во внешнюю оболочку приводит к значительному повышению электроотрицательности (χ =3). Отсюда вытекают два следствия. Связи азота с углеродом и водородом полярны. Это влечет за собой усиление межмолекулярного взаимодействия. Водород, связанный с азотом, может образовывать водородные связи. Это имеет решающее значение как для формирования структуры биомолекул, так и для протекания биохимических процессов.
 В теле человека содержится1800 г азота. В клетках азот образует различные группы при участии углерода и водорода. В аминокислотах и белках имеется аминогруппа –NH2 с наиболее сильными основными свойствами. При рН 7,4 внутренней среды клеток, аминогруппа почти полностью протонирована до –NH3+. Но в амидной группе –CONH2 основность азота сильно понижена вследствие сопряжения его электронной пары с карбонильной группой. Донорные свойства азота обеспечивают также образование связей с ионами биогенных микроэлементов железа, кобальта, меди, магния.
В теле человека содержится1800 г азота. В клетках азот образует различные группы при участии углерода и водорода. В аминокислотах и белках имеется аминогруппа –NH2 с наиболее сильными основными свойствами. При рН 7,4 внутренней среды клеток, аминогруппа почти полностью протонирована до –NH3+. Но в амидной группе –CONH2 основность азота сильно понижена вследствие сопряжения его электронной пары с карбонильной группой. Донорные свойства азота обеспечивают также образование связей с ионами биогенных микроэлементов железа, кобальта, меди, магния.
Азот присутствует также в составе иминогруппы –С=N–. Такие группы имеются в гетероциклических основаниях. Третичные атомы азота в биоорганических веществах встречаются реже (пример NADH), Четвертичный атом азота имеется в холине (ацетилхолин хлорид CH3COOCH2CH2N+(CH3)3Cl–).
Окисленный азот в составе нитрат- и нитрит-ионов попадает в организм с пищей. Это токсичные и нежелательные соединения. Особенно токсичны нитриты, окисляющие в гемоглобине железо(II) до железа(III). Однако оксид NO или какое-то нитрозосоединение в концентрации около 10–7 моль/л является фактором расслабления гладких мышц сердца. С учетом этого, проясняется роль нитроглицерина, принимаемого при сердечных спазмах.
Выведение избытка азота из организма осуществляется в виде карбамида (амида угольной кислоты, мочевины). Это кристаллическое вещество с очень большой растворимостью в воде. Метаболизм азота построен так, что простое вещество N2 в организме не образуется, так как это очень малорастворимый в воде газ. Образование пузырьков азота приводило бы к закупорке кровеносных сосудов. Карбамид является одним из веществ, которые трудно однозначно отнести к неорганическим или органическим веществам.
В перечислим важнейшие функции азота:
- выполняет структурную функцию в белках, образуя пептидные связи;
- образуемые азотом водородные связи стабилизируют вторичную структуру белков и двойную спираль ДНК;
- связывает ионы металлов в ферментах и гемоглобине;
- холин, содержащий четвертичный азот, обеспечивает передачу сигнала в синапсах;
- азот в виде NO необходим для расслабления гладкой мускулатуры.
Второй элемент группы VA фосфор близок в азоту только по электронной структуре атома, но в химическом поведении этих элементов проявляются коренные различия. Азот образует крайне не активное простое вещество N2. Фосфор образует не менее трех простых веществ, среди которых очень активный и ядовитый белый фосфор. Азот образует устойчивые водородные соединения. Водородные соединения фосфора легко распадаются. Кислородные соединения азота (оксиды, кислоты, соли) сравнительно малоустойчивы, и являются сильными окислителями. Кислородные соединения фосфора, особенно фосфора(V), отличаются высокой устойчивостью. Биологическая необходимость фосфора связана только с реакциями фосфатов, то есть солей, ионов и эфиров фосфорной кислоты. Все другие соединения фосфора, кроме фосфатов, токсичны или даже крайне токсичны. Различие в устойчивости оксидов и кислот фосфора и азота видно из сравнения изменений энергии Гиббса:
| D fG °, кДж/моль | D fG °, кДж/моль | ||
| N2O5 (кр) | +113,9 | HNO3(ж) | –80,7 |
| P2O5 (кр) | –1006 | H3PO4(ж) | –1271,7 |
Фосфатный фрагмент РО4 оказывается единственной формой нахождения фосфора в организме. Только при его участии осуществляются все биологические функции фосфора. Было бы вполне правильно говорить не о биологической роли фосфора, а о биологической роли фосфатов. К ним и сводится биологическая роль фосфора.
В теле человека содержится 780 г фосфора. Из этой массы 700 г находится в костях. Вы уже знаете, что главное минеральное вещество костей кристаллический гидроксидфосфат кальция Ca5(PO4)3OH. Эти кристаллы как бы склеены тонким слоем аморфного фосфата кальция Ca3(PO4)2. Замещение ионов кальция примесными катионами приводит к появлению в костях фосфатов стронция, свинца и др.
В жидких средах организма при рН 7,4 одновременно содержатся анионы фосфорной кислоты НРО42– и Н2РО4– в молярном соотношении 4,5:1. При небольших отклонениях рН от нормы это отношение изменяется. Оба иона составляют одну из буферных систем крови и клеток.
Чрезвычайно велика роль моно-, ди- и трифосфатов в энергетике клеток. В протонированной форме это ортофосфорная Н3РО4, дифосфорная Н4Р2О7 и трифосфорная Н5Р4О10 кислоты. Фактически анионы этих кислот находятся в клетках в форме эфиров с аденозином и некоторыми другими биомолекулами. Все процессы преобразования энергии и передачи ее на осуществление эндоэргонических (не самопроизвольных) биохимических реакций идут при участии трифосфатов (АТФ), дифосфатов (АДФ) и, в некоторых случаях монофосфатов. Фосфаты оказались уникальными веществами для биоэнергетики, так как в связях между фосфатными группами О–Р–О–Р–О–Р–О запасается энергия, достаточная для осуществления практически всех не самопроизвольных реакций замещения, поликонденсации и восстановления в биомолекулах. Реакции окисления биомолекул идут самопроизвольно. За счет их энергии идет зарядка энергетического аккумулятора, то есть фосфорилирование АДФ с образованием АТФ. Циклы повторяются. За сутки происходит приблизительно 2500 циклов превращения
АТФ + Н2О = АДФ + Ф; АДФ + Ф = АТФ + Н2О
Использование энергии Энергетическая зарядка
в сопряженных реакциях
Пригодность полифосфатов для передачи энергии определяется еще и тем, что гидролиз их, не сопряженный с биохимическими реакциями, идет медленно. Пирофосфат превращаются в обычные фосфаты при кипячении раствора. А иначе запасенная энергия в молекулах АТФ тривиальным образом переходила бы при гидролизе в теплоту.
В переносе фосфата в клетках с образованием АТФ участвует еще одна своеобразная молекула креатинфосфат. Это единственный пример, когда атом фосфора связан с тремя атомами кислорода, а четвертым заместителем оказывается азот:
 HN–PO3H2
HN–PO3H2
 HN=C–N–CH2–COOH
HN=C–N–CH2–COOH
CH3
В биологических процессах образуется много других эфиров фосфорной кислоты, так как превращения молекул начинаются с их фосфорилирования. Молекулы ДНК и РНК являются полиэфирами фосфорной кислоты. В клеточных мембранах имеются фосфолипиды, в которых глицерин образовал две эфирные связи с остатками карбоновых кислот и одну с фосфатной группой.
Из приведенного материала можно сделать самый буквальный вывод, что без фосфатов жизнь остановилась бы, лишившись механизма распределения энергии.
Итак, фосфаты выполняют структурную функцию в костях и в биополимерах. Неоценима также их роль в энергетических процессах и в биозинтезе эндоэргонических веществ.
Элементы группы VIA (группа кислорода). Из четырех устойчивых элементов группы кислорода (O, S, Se, Te) три биогенные элементы: макроэлементы кислород (43000 г в теле человека) и сера (140 г), и микроэлемент селен (0,013 г). Кислород самый распространенный элемент земной коры, чем определяется состояние большинства других элементов и характер процессов в биосфере. Сера также относится к элементам с высоким содержанием в земной коре (0,026%) и легко доступным для живых организмов. Селен в природе постоянный спутник серы с содер-жанием приблизительно 1 атом селена на 10000 атомов серы.
Элементы группы кислорода имеют по 6 электронов на внешних подуровнях ns и np -подуровнях. В их атомах остается по 2 неспаренных электрона. Поэтому для всех элементов характерно двухвалентное состояние. При этом атомы имеют по две валентные электронные пары, при участии которых образуется одна или реже две связи по донорно-акцепторному механизму. Донорные свойства кислорода слабее, чем азота. Кислород имеет высокую электроотрицательность (χ= 3,5), и является самым электроотрицательным среди биогенных макроэлементов. Поэтому молекулы биоорганических соединений, содержащих кислород, сильно полярны. Водород, связанный с кислородом, образует наиболее прочные водородные связи.
В кислородсодержащих биоорганических веществах встречаются многие функциональные группы: спиртовая и фенольная ОН-группы, альдегидная и кетоновая окси-группы, кислотная группа –СООН, сложноэфирная группа –СООR. Сочетание двух и более атомов кислорода у одного центрального атома создает условия для возникновения сильной ОН-кислотности. Кислоты оказываются важнейшими биоорганическими соединениями. Следует напомнить, что при физиологическом значении рН 7,4 кислоты находятся в депротонированной форме (в виде анионов).
Необходимо отметить и наличие кислородсодержащих неорганических биогенных веществ. Большая часть кислорода находится в составе воды, биологического растворителя, в котором и происходят все биохимические и физиологические процессы. Далее следует перечислить фосфаты, карбонаты, о роли которых уже говорилось, и сульфаты. В итоге оказывается, что веществ, не содержащих кислород, в живых организмах очень мало.
В соединениях со всеми элементами, кроме фтора, кислород имеет отрицательную степень окисления. Поэтому молекулярный кислород О2, образуя прочные химические связи с большинством элементов, является сильным окислителем. Одна из главных функций кислорода – это окисление органических соединений с выделением энергии. На примере кислорода можно полнее оценить удивительные возможности биохимических процессов. Наряду с реакциями окисления при участии кислорода, другие живые клетки снабжены структурами, в которых энергия излучения используется для окисления кислорода, содержащегося в углекислом газе и воде, до О2 с параллельным образованием глюкозы. Окисление органических веществ кислородом, и фотохимическое окисление самого кислорода представляют собой главное содержание круговорота химических элементов в биосфере.
К числу важнейших свойств кислорода, определяющих его биохимическую роль, относится относительно низкая реакционная способность простого вещества. При температурных условиях существования жизни кислород не окисляет и тем более, не воспламеняет большинство органических веществ. Значение этого факта становится очевидным, если сравнить свойства кислорода О2 со свойствами озона О3. Неустойчивый озон, молекула которого отщепляет атом кислорода, необычайно химически активен. Он окисляет органические вещества при первом же соприкосновении. Поэтому примесь озона в воздухе более 0,1 мг/м3 становится опасной для здоровья. Озон вызывает поражение дыхательных путей.
Суммируя, можно сказать, что кислород необходим для жизни как окислитель; как элемент, образующий воду; как фактор кислотных свойств веществ; как участник образования водородных связей; как донорный атом, связывающий ионы металлов.
Хорошо изучена биохимическая роль макроэлемента серы. Сера в организме находится преимущественно в двухвалентном состоянии в белках и некоторых коферментах, и в шестивалентном состоянии в виде ионов и эфиров серной кислоты. Сера входит в состав двух белковых аминокислот цистеина HSCH2CH(NH2)COOH и метионина CH3SCH2CH2CH(NH2)COOH. При окислении серы в радикалах цистеина возникают мостики между удаленными участками пептидной цепи:

В свободном состоянии выделена окисленная форма цистеина – цистин:
HOOCCH(NH2)CH2S–SCH2CH(NH2)COOH
Дисульфидные мостики поддерживают третичную структуру белка. Выше (лекция 19) такой мостик изображен в концевой петле кальцитонина. Образование связей S–S часто наблюдается в химических реакциях серы (молекулы S8 пластическая сера Sn). Мостики S–S могут возникать не только внутри пептидной цепи, но и между цепями (инсулин, иммуноглобулины), создавая четвертичную структуру полипептида.
Относительно сильной кислотностью характеризуются тиольные группы –SH в биоорганических молекулах. По силе они не очень сильно уступают сероводороду. Это подтверждается сравнением силовых показателей сероводорода, этиленгликоля и 2-меркаптоэтанола: p Ka (H2S) = 7,05; p Ka (HO(CH2)2OH) = 15,1; p Ka (HO(CH2)2SH) = 9,72. Поэтому тиоловая или сульфгидрильная группа играет важную роль мягкого основного центра, легко переходящего в заряженное состояние, то есть в R–S–. Примером может служить участие концевой SH-группы молекулы кофермента А (СоА) в связывании и переносе ацетила CH3CO:

 CH3CCOO– + CoA SH + H+ = CO2↑ + CoA S–CCH3 + 2H
CH3CCOO– + CoA SH + H+ = CO2↑ + CoA S–CCH3 + 2H
O O
Блокирование SH-группы в результате связывания мягкой кислоты Льюиса (иона тяжелого металла) нарушило бы промежуточную стадию метаболизма глюкозы – декарбоксилирование пировиноградной кислоты.
Меньшая доля серы в теле человека находится в шестивалентном состоянии. Около 6,6 г серы образует в хрящах хондроитинсерную кислоту, представляющую собой полимерный эфир серной кислоты. В переносе сульфатных групп SO4 участвует нуклеотид 3´-фосфоаденозин-5´-фосфосульфат. Сульфатная группа здесь связана с фосфатом:


 O O
O O

 A –O–P–O–S–O–
A –O–P–O–S–O–
O– O–
Сульфат-ион постоянно присутствует в плазме крови среди других анионов. В медицине применяются многие сульфаты:
Сульфат натрия слабительное. Действие основано на непроницаемости стенок кишечника к ионам SO42–; вследствие этого пищеварительная система удерживает значительное количество воды;
Сульфат магния слабительное (как и Na2SO4), а также сосудорасширяющее (внутривенно);
Сульфат кальция Сa2SO4·0,5H2O применяется для наложения фиксирующих повязок при переломах. Действие основано на гидратации и затвердевании в виде Сa2SO4·2H2O;
Сульфат бария применяется при рентгеноскопии пищеварительных органов, как соль тяжелого металла, поглощающего рентгеновские лучи;
Калий-алюминивые квасцы KAl(SO4)2·12H2O – вяжущее;
Сульфат цинка – вяжущее в глазных каплях, 5%-ный раствор;
Сульфат меди – противоядие при отравлениях фосфором;
Сульфат железа(II) – противоанемическое.
Ранее на лекции упоминался тиосульфат натия Na2S2O3. Это соль, отличающаяся от сульфата заменой атома кислорода на атом серы. В веществе имеется связь S=S. Анион соли сильный комплексообразователь, так как содержит мягкий донорный атом серы.
Микроэлемент селен обнаружен в некоторых ферментах, с составе которых имеется селеноциcтеин HSeCH2CH(NH2)COOH. При недостатке селена повышается опасность возникновения сердечно-сосудистых заболеваний.
Элементы группы VIIA (галогены). Не будем сегодня рассматривать свойства и закономерности изменения свойств в группе галогенов. В этой группе находятся 4 устойчивых элемента, из которых только бром не приобрел статуса биогенного элемента. Однако его несомненное влияние на нервную систему позволяет предполагать, что имеющийся в организме бром (0,2 г) необходим для стабилизации нервных процессов.
Макроэлементом является хлор (95 г), содержащийся в крови в виде раствориых солей, то есть фактически в виде анионов Cl–. Ионы хлора имеются как в клетках, так и в межклеточных жидкостях, где присутствуют также катионы натрия и калия. Поэтому можно считать что соли хлорид натрия и хлорид калия являются практически единственными не содержащими кислорода веществами и теле человека. Ион хлора безвреден, и необходим для поддержания нормальной концентрации катионов. Этот ион практически не участвует в нормальных, существенных биохимических процессах.
Первый элемент группы галогенов фтор отличается от остальных галогенов высокой жесткотью аниона F–, превышающей жесткость воды. Поэтому у ряда катионов, включая Ca2+, образующих растворимые хлориды, бромиды и иодиды, фториды оказываются нерастворимыми. В этом причина концентрирования фтора в костях.
Фтор относят к биогенным элементам, так как он входит в состав зубной эмали в виде фторапатита Ca5(PO4)3F, придающего твердость, непроницаемость и, согласитесь, красоту поверхности зуба. В зубах содержится 3,5 мг фтора, а во всем организме, главным образом в костях, 2,6 г фтора. Кажется вполне вероятным предположение, что почти весь имеющийся в организме фтор является примесным.
Надежно охарактеризованным биогенным микроэлементом является иод. Он необходм для работы щитовидной железы. Удивительна степень концентрирования иода в этой железе. Из 13 мг иода, имеющегося в организме, 12 мг находятся в щитовидной железе массой 20 г. Можно вычислить, что концентрация иода в железе в 40000 раз больше, чем в остальном теле. Это пример самой высокой избирательности по отношению к определенному виду атомов.
Химические связи иод образует с атомами углерода ароматического кольца тирозина в соответствии с закономерностями реакций замещения в ароматическом кольце. Образуются иод- и дииодтирозин:

Более сложной аминокислотой является тиронин. Его замещенное производное с четырьмя атомами иода называется тироксин.

Эти иод-производные входят в состав гормонов щито-видной железы.
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 1090; Нарушение авторских прав?; Мы поможем в написании вашей работы!