
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Длина связи – кратчайшее расстояние между ядрами атомов
|
|
|
|
O
Атомные и ионные радиусы
Квантово - механическая модель атома позволяет считать, что атом не имеет строгих границ. Поэтому атомные и ионные радиусы имеют условные границы.
 Орбитальные радиусы – это теоретически рассчитанные положения главного максимума плотности внешних электронных облаков.
Орбитальные радиусы – это теоретически рассчитанные положения главного максимума плотности внешних электронных облаков.
Атомные радиусы в периоде уменьшаются с возрастанием порядкового номера. Исключение: радиус возрастает от кислорода к фтору.

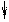
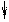


 N
N

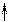

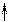


 F
F
Это можно объяснить размещением электронов на уже занятых орбиталях, что приводит к отталкиванию электронов и возрастанию радиуса.
В группах с увеличением номера элемента возрастает атомный радиус.
Однако ионные радиусы играют большую роль, чем атомные. И их изменение связано с изменением межатомных расстояний. Ионный радиус зависит от природы элемента и заряда иона. Например: S2- S4+ S6+ имеют радиусы 0,174; 0,037; 0,030 соответственно. Т.е. чем выше заряд, тем меньше радиус.
Ионы s и p – элементов имеют большие радиусы, по сравнению с d – элементами. Это связано с тем, что при переходе к d – элементам заряд возрастает, а электроны заполняют внутреннюю оболочку. Это приводит к увеличению взаимодействия электронов с ядром и следовательно – уменьшение радиуса. Этот эффект называют – d – сжатием. Аналогично происходит лантоноидное сжатие. Однако говоря об ионных радиусах нужно помнить, что эти величины очень условны и радиус элемента в разных соединениях имеет разные значения.
Итак, заканчивая обзор периодической системы необходимо сделать вывод, что основная причина периодической повторяемости свойств заключается в электронной конфигурации атомов, которая периодически повторяется. Основное значение этой системы заключается в том, что она связывает строение атома с его положением в системе. Знание электронного строения позволяет прогнозировать химические свойства соединений и направление химических реакций.
|
|
|
ЛЕКЦИЯ № 3
Химическая связь и строение химических соединений
Атомы большинства элементов взаимодействуют между собой или другими атомами, при этом между атомами возникает химическая связь.
 Химическая связь – это совокупность сил, связывающих атомы или молекулы друг с другом в новые устойчивые структуры.
Химическая связь – это совокупность сил, связывающих атомы или молекулы друг с другом в новые устойчивые структуры.
Результатом этих взаимодействий являются многоатомные частицы. К частицам относят: молекулы, молекулярные ионы, комплексы.
 Молекула – мельчайшая частица вещества, сохраняющая его химические свойства, способная к химическим превращениям.
Молекула – мельчайшая частица вещества, сохраняющая его химические свойства, способная к химическим превращениям.
Молекула – устойчивая нейтральная система, состоящая из нескольких атомов.
Молекулярные ионы – многоатомные частицы, несущие заряд.
Комплексы – продукты взаимодействия молекул и ионов (рассматривают на лекции "Комплексные соединения").
 В образованных частицах различают ковалентную, ионную и металлическую связь. Для химиков наибольший интерес представляет ковалентная связь, которая характерна для большинства химических (органических) соединений.
В образованных частицах различают ковалентную, ионную и металлическую связь. Для химиков наибольший интерес представляет ковалентная связь, которая характерна для большинства химических (органических) соединений.
Ковалентная связь – связь образованная электронами, принадлежащими обоим атомам, образующим частицу (Например: Н2, Cl2, СН4 и т.д.). Эта связь характеризуется параметрами: энергией связи, длиной связи, валентным углом.
Энергия связи рана энергии разрыва связи.
Валентный угол – угол образованный воображаемыми прямыми, проведенными через центры ядер атомов, образующих частицу.
Этот параметр характеризует частицы, содержащих в своем составе не менее 3-х атомов.
Вопрос о природе химической связи является центральным, поскольку это один из основных факторов, определяющих химические свойства вещества. В настоящее время различают два подхода к изучению химической связи – метод валентных связей и метод молекулярных орбиталей.
|
|
|
Метод валентных связей (МВС)
В основе МВС лежит предположение о том, что при образовании молекулы атомы сохраняют свою электронную конфигурацию. Силы, связывающие атомы, обусловлены обменом электронов между атомами.
Основные положения образования химической связи основанной на МВС:
1. связь образуется при взаимодействии атомов с неспаренными электронами.
2. химическую связь образуют атомы, электроны которых обладают антипараллельными спинами.
3. при возникновении химической связи образуется общая электронная пара, т.е. связь имеет двухэлектронный характер.
4. число общих электронных пара определяет валентность элементов, образующих химическую связь.
5. связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака
Рассмотрим, как согласуются эти положения на примере образования молекулы водорода.
С уменьшением расстояния между атомами увеличивается их притяжение, но усиливается электростатическое взаимное отталкивание. По мере сближения силы притяжения достигают максимума, что способствует образованию молекулы. Образование химической связи является результатом взаимопроникновения (перекрывания) электронных облаков, происходящие при сближении атомов. При этом в межъядерном пространстве возрастает плотность отрицательного заряда. Это вызывает притяжение ядер к области перекрывания электронных облаков. В результате образуется устойчивая молекула. Устойчивость подтверждена расчетами межъядерного расстояния, энергии связи (полученные Гейтлером и Лондоном). Наряду с молекулой водорода были сделаны расчеты для молекулы Н3. Такая система оказалась не устойчива. Таким образом:
1) каждый атом может образовывать химическую связь только с определенным числом других атомов;
2) для образования химической связи необходимы неспаренные электроны.
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 1394; Нарушение авторских прав?; Мы поможем в написании вашей работы!