
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Механизм образования ковалентной связи
|
|
|
|
В методе ВС различают обменный и донорно - акцепторный механизм образования ковалентной связи.
При обменном механизме – химическая связь образуется за счет неспаренных электронов атома. В этом механизме образования связи могут участвовать s, p, d – электроны.
Например:

Примером образования молекул по донорно – акцепторному механизму является образование иона аммония (NH4+). У атома азота в молекуле аммиака три р – орбитали, образующие связь с Н по обменному механизму. Одна s – орбиталь занята неподеленной электронной парой. Ион водорода имеет одну вакантную (свободную) орбиталь. Химическая связь возникает благодаря тому, что неподеленная пара электронов атома азота занимает вакантную орбиталь иона водорода. Таким образом появляется общая электронная пара.
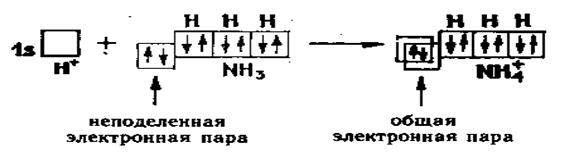
Частица, представляющая неподеленную электронную пару, называется донором, а вакантную орбиталь – акцептором. Этот механизм образования называют донорно – акцепторным.
В результате рассмотренных механизмов образования ковалентной связи можно сделать вывод о том, что максимальная ковалентность атома определяется числом неспаренных электронов и (вакантных орбиталей) неподеленных электронных пар.
Типы ковалентной связи
Различают ковалентную связь: d, p - типа.
d - связь образуется при перекрывании электронных орбиталей вдоль оси связи, соединяющей ядра атомов. Она образуется при перекрывании s, p, d – орбиталей.

p - связь – образуется перекрыванием электронных облаков по линии, перпендикулярной оси связи. Такую связь образуют p и d – орбитали
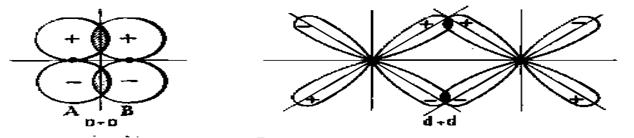
Наиболее прочной является d - связь. Поскольку атомы элементов могут участвовать в образовании нескольких связей, то в этом случае возникают кратные связи. Например, в молекуле этилена — 1d и 1p - связи; в молекуле азота одна d и 2p - связи.
|
|
|
Кратность ковалентной связи характеризуется числом общих электронных пар между соединенными атомами.
Характеристика ковалентной связи
Насыщенность. Под насыщенностью понимают способность атома образовывать строго определенное количество связей. Она определяется числом неспаренных электронов.
 Например: у атома водорода есть один неспаренный электрон, он образует одну связь. Однако такой подход не объясняет всей сложности образования связи. Например: атом хлора имеет один неспаренный электрон и может образовывать одну химическую связь. Но хлор может образовывать 3,5,7 связей. Это объясняется тем, что электроны на некоторых орбиталях в определенных условиях могут распариваться. Электроны переходят на свободную орбиталь При этом атом переходит в возбужденное состояние, появляется 7 неспаренных электронов и хлор способен образовывать 7 ковалентных связей.
Например: у атома водорода есть один неспаренный электрон, он образует одну связь. Однако такой подход не объясняет всей сложности образования связи. Например: атом хлора имеет один неспаренный электрон и может образовывать одну химическую связь. Но хлор может образовывать 3,5,7 связей. Это объясняется тем, что электроны на некоторых орбиталях в определенных условиях могут распариваться. Электроны переходят на свободную орбиталь При этом атом переходит в возбужденное состояние, появляется 7 неспаренных электронов и хлор способен образовывать 7 ковалентных связей.
Cl 1s22s22p63s23p53d0
Направленность связей. Направленность связи может быть объяснена направленностью атомных орбиталей в пространстве (все орбитали, кроме s имеют направленность). Направленность связи обуславливает геометрическую форму молекул. В МВС геометрия молекул связана с понятием гибридизации.
Гибридизация – это процесс соединения различного типа, близких по энергии атомных орбиталей с возникновением новых гибридных орбиталей равных по форме и энергии.
Суть этого понятия – различные орбитали, близкие по энергии, могут быть заменены тем же количеством орбиталей, одинаковых по энергии и форме. Эти орбитали называют гибридными. Гибридные орбитали образуются из s, p, d – орбиталей. Например: атом С может иметь 3 состояния: sp3, sp2, sp. Рассмотрим молекулу СН4. У атома С в образовании молекулы участвуют р-орбитали и валентный угол между ними должен быть 900. Экспериментально доказано, что угол связи 10905' – следовательно тип гибридизации sp3.
|
|
|
Но в гибридизации участвовать могут неподеленные электронные пары. Например – в молекуле Н2О. В соответствии со строением атома кислорода
в образовании молекулы воды должны принимать участие р-орбитали.
 8О 1s2 2s2 2p4
8О 1s2 2s2 2p4
Валентный угол (угол между р-орбиталями) должен быть равен 90. Экспериментально установлено, что он составляет 10405/, т.е. угол близок к углу гибридизации sp3.. Таким образом, вначале экспериментально устанавливают геометрию молекулы, а потом описывают тип и форму атомных орбиталей, т.е. определяют тип гибридизации.
Полярность связи. Важное значение для химических свойств молекул имеет распределение заряда в молекулах. В зависимости от распределения заряда различают полярные и неполярные молекулы. О полярности удобнее говорить на примере двухатомной молекулы. Если молекула образована разными атомами, которые различаются по элекроотрицательности, то связь в ней будет полярной. В этом случае электронная плотность общей электронной пары смещается к более электроотрицательному атому. Это приводит к появлению на атоме частичного отрицательного заряда. Молекула представляет собой диполь, т.к. центры отрицательных и положительных зарядов находятся на некотором расстоянии
|
|

 Н Cl d-
Н Cl d-
 |
Количественной характеристикой полярности является величина дипольного момента
 m =
m = 
m - дипольный момент (векторная величина)
d - заряд полюса диполя
l – расстояние между зарядами
Однако полярность зависит не только от природы атомов, образующих связь, но и геометрии молекул. Для многоатомных молекул дипольный момент равен векторной сумме дипольных моментов отдельных связей.

 Например: СО2 неполярная молекула, хотя связь полярна. Это объясняется тем, что моменты связей направлены в разные стороны, результирующий момент равен нулю О С О d-О = Сd+ = Оd-
Например: СО2 неполярная молекула, хотя связь полярна. Это объясняется тем, что моменты связей направлены в разные стороны, результирующий момент равен нулю О С О d-О = Сd+ = Оd-
Молекула NО2 полярна, постольку молекула угловая, моменты связи не уравновешаны
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 3174; Нарушение авторских прав?; Мы поможем в написании вашей работы!