
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Законы, описывающие поведение идеальных газов - законы Бойля-Мариотта, Авогадро, Дальтона, Гей-Люссака
|
|
|
|
Температура - физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы и определяющая направление теплообмена между телами.
В настоящее время используют две температурные шкалы.
Международная практическая шкала (шкала Цельсия)градуированная в градусах Цельсия (°С) по двум реперным точкам - температурам замерзания и кипения воды при давлении 1,013-105 Па, которые принимаются соответственно 0°С и 100°С.
Термодинамическая температурная шкала (шкала Кельвина), градуированная в градусах Кельвина (К) определяется по одной реперной точке - тройной точке воды - температуре, при которой лед, вода и насыщенный пар при давлении 609 Па находятся в термодинамическом равновесии. Температура этой точки по данной шкале равна 273,15 К. Температура Т=0Кназывается нулем Кельвина.
Термодинамическая температура (Т) и температура (t) по Международной практической шкале связаны соотношением
T=273,15+t
Нормальные условия То =273,15 К = 0°С, р0 =101325 Па.
4. Идеальный газ.
Физическая модель, согласно которой:
1)собственный объем молекул газа пренебрежимо мал по сравнению с
объемом сосуда;
2)между молекулами газа отсутствуют силы взаимодействия;
3)столкновения молекул газа между собой и со стенками сосуда
абсолютно упругие.
Исходя из этого идеальный газ можно рассматривать как совокупность беспорядочно движущихся молекул-шариков, имеющих пренебрежимо малый собственный объем и не взаимодействующих друг с другом на расстоянии.
 5. Закон Бойля-Мариотта.
5. Закон Бойля-Мариотта.
Для данной массы газа m при постоянной температуре Т произведение давления р на объем V есть величина постоянная:
pV = const при Т = const и m=const.
Кривая, изображающая зависимость между р и V, характеризующая свойства вещества при постоянной температуре, называется изотермой. Изотермы — гиперболы, расположенные на графике тем выше, чем выше температура происходящего процесса.
|
|
|
6. Закон Авогадро.
Количество вещества v -физическая величина, определяемая числом специфических структурных элементов - молекул, атомов или ионов, из которых состоит вещество.
Единица количества вещества - моль - количество вещества системы, содержащей столько же структурных элементов, сколько содержится в 0,012 кг изотопа углерода 12С.
В одном моле различных веществ содержится одно и то же число молекул N А, называемое числом Авогадро.
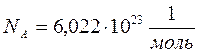
Закон Авогадро: моли любых газов при одинаковой температуре и давлении занимают одинаковые объемы.
При нормальных условиях (Т =Т0, р = р0) этот объем V (молярный объем) равен:
(молярный объем) равен:

Молярная масса 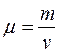 - это масса одного моля вещества. Отсюда:
- это масса одного моля вещества. Отсюда: 
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 620; Нарушение авторских прав?; Мы поможем в написании вашей работы!