
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энтропии. Термодинамическая вероятность. Статистический смысл понятия
|
|
|
|
Термодинамическая вероятность. Статистический смысл понятия
1. Энтропия системы с точки зрения статистической физики. Итак, в термодинамике было выяснено, что энтропия определяет направление протекания процессов в замкнутых системах.
В статистической физике энтропия системы раскрывается с другой стороны, ее можно связать с тепловым движением молекул. Рассуждения при этом будут следующими.
Если система самопроизвольно переходит из неравновесного состояния в равновесное, то это означает, что она самопроизвольно переходит из состояний менее вероятных в состояния более вероятные, причем равновесное состояние обладает наибольшей вероятностью, так как в нем система может находиться сколь угодно долго при неизменных внешних условиях.
Следовательно, необратимость процессов связана с переходом системы из состояний менее вероятных в состояния более вероятные. Конечно, возможно протекание и обратных процессов, при которых система переходит из более вероятных состояний в менее вероятные, но вероятность осуществления таких процессов будет чрезвычайно малой.
Так, например, с точки зрения молекулярной физики стакан, который упал со стола и разбился, имеет не равную нулю вероятность подняться на стол и стать снова целым. Но вероятность такого процесса будет чрезвычайно малой, и на практике такие процессы не наблюдаются.
Для того чтобы количественно оценить вероятность различных состояний системы, вводят понятие термодинамической вероятности (статистического веса)  - это числа микросостояний системы, которые соответствуют данному макросостоянию системы. Причем, по определению,
- это числа микросостояний системы, которые соответствуют данному макросостоянию системы. Причем, по определению,  .
.
В статистической физике принята гипотеза о том, что все микросостояния данной системы являются равновероятными. Это означает, что вероятность макросостояния пропорциональна еe термодинамической вероятности  .
.
|
|
|
Молекулы, участвуя в тепловом движении, со временем хаотично движутся и непрерывно изменяют свои координаты и скорости. Поэтому данному макросостоянию системы будет соответствовать чрезвычайно большое число микросостояний, которое не так просто оценить.
Относительно термодинамической вероятности  можно отметить следующее.
можно отметить следующее.
1) она так же, как и энтропия, возрастает при переходе замкнутой системы из неравновесного состояния в состояние равновесия;
2) она так же, как и энтропия, является наибольшей в состоянии равновесия;
3) она так же, как и энтропия является функцией состояния системы;
4) она характеризует степень хаотичности в движении молекул по координатам и скоростям;
5) в отличие от энтропии она является мультипликативной функцией состояния системы, т.е. для системы, состоящей из двух невзаимодействующих подсистем она равна произведению термодинамических вероятностей этих подсистем ( ).
).
Энтропия же является аддитивной функцией состояния системы, т.е. энтропия системы, состоящей из двух невзаимодействующих частей, равна сумме энтропий этих частей ( ).
).
Сравнивая свойства энтропии и термодинамической вероятности, можно заметить много общего между ними. Больцман показал, что введенное в термодинамике понятие энтропии связано с термодинамической вероятностью формулой
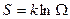 , (2.68)
, (2.68)
где 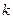 - постоянная Больцмана.
- постоянная Больцмана.
Отметим, что входящее в формулу выражение 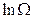 , так же как и энтропия, является аддитивной величиной.
, так же как и энтропия, является аддитивной величиной.
Записанная формула раскрывает статистический смысл энтропии, а именно энтропия системы является мерой хаотичности в движениях молекул по координатам и скоростям. Формула (2.72) позволяет также провести оценку энтропии для неравновесных состояний.
|
|
|
Приведем формулировку второго начала термодинамики с точки зрения статистической физики - в замкнутой системе вероятнее всего протекают процессы с увеличением энтропии, процессы с уменьшением энтропии маловероятны.
Эта формулировка носит вероятностный смысл, она не запрещает протекание процессов, происходящих с уменьшением энтропии, они могут протекать в замкнутой системе, но они будут маловероятными.
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 227; Нарушение авторских прав?; Мы поможем в написании вашей работы!