
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Понятие о стандартном окислительно-восстановительном потенциале. Направление окислительно-восстановительных процессов
При использовании инертных электродов в гальванических элементах (угольно-графитовых, платиновых) материал электрода играет только роль переносчиков электронов. Для количественной характеристики окислительно-восстановительных систем в таком случае используют значения стандартных окислительно-восстановительных (редокс) потенциалов (см. табл. 2).
Eок/восст = E0ок/восст + 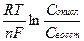 , Еок/восст = Е0ок/восст +
, Еок/восст = Е0ок/восст + 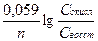 ,
,
где Сокисл - концентрация окисленной формы, моль/л;
Свосст - концентрация восстановленной формы, моль/л
В общем виде равновесие на электродах для простых систем записывается уравнением:
Окисл. форма + ne Û Восст. форма
Разность стандартных электродных потенциалов окислителя и восстановителя дает величину электродвижущей силы гальванического элемента (Е)
Е = Е0окисл - Е0восст
Из соотношения  следует, что возможны только те окислительно-восстановительные процессы, которые обеспечивают положительное значение ЭДС (Е).
следует, что возможны только те окислительно-восстановительные процессы, которые обеспечивают положительное значение ЭДС (Е).
По величинам окислительно-восстановительных потенциалов можно судить о направлении окислительно-восстановительных процессов.
Пример 1

 Реакция Sn2+Cl2 + 2Fe3+Cl3 2Fe2+Cl2 + Sn4+Cl4
Реакция Sn2+Cl2 + 2Fe3+Cl3 2Fe2+Cl2 + Sn4+Cl4

 Sn2+ + 2Fe3+ 2Fe2+ + Sn4+
Sn2+ + 2Fe3+ 2Fe2+ + Sn4+
 Sn2+ – 2e Sn4+ ; Е0 Sn4+ / Sn 2+ = 0,15 B
Sn2+ – 2e Sn4+ ; Е0 Sn4+ / Sn 2+ = 0,15 B
 Fe3+ + e Fe2+ ; Е0 Fe3+ / Fe 2+ = 0,77 B,
Fe3+ + e Fe2+ ; Е0 Fe3+ / Fe 2+ = 0,77 B,
протекающая в гальваническом элементе с инертными электродами (рис. 4), будет идти в прямом направлении, так как ЭДС положительна при условии, что система Sn4+ / Sn 2+ будет восстановителем, а система Fe3+ / Fe 2+ - окислителем:
E = Е0ок - Е0восст. = Е0 Fe3+ / Fe 2+ - Е0 Sn4+ / Sn 2+ = 0,77 – 0,15 = 0,62 B
|
| ||||
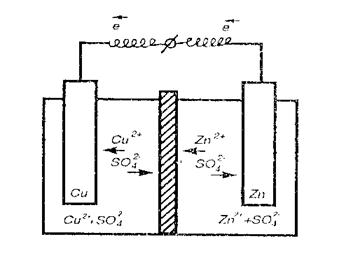
Рис.4 Схема гальванического элемента с инертными электродами.



 Схематическая запись данного гальванического элемента будет иметь вид:(-) Sn2+ Sn 4+ Fe3+ Fe 2+ (+)
Схематическая запись данного гальванического элемента будет иметь вид:(-) Sn2+ Sn 4+ Fe3+ Fe 2+ (+)
|
Дата добавления: 2013-12-14; Просмотров: 607; Нарушение авторских прав?; Мы поможем в написании вашей работы!