
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вплив процесу заморожування на властивості харчових продуктів
|
|
|
|
T зам – зниження температури замерзання розчину порівняно з чистим розчинником; ∆t зам = tзам Н2О – tзам розчину
Tзам – температура замерзання розчину (Р пари над розчином = Р пари льоду); tзам розчину < tзам Н2О
Tкип – підвищення температури кипіння розчину порівняно з чистим розчинником: ∆tкип = t кип розчину – t кип Н2О
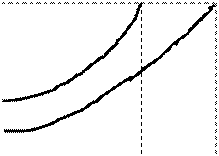
Залежність Р насиченої пари від температури над чистим розчинником і над розчином
Температура кипіння рідини – це температура, за якої тиск її насиченої пари стає таким, що дорівнює зовнішньому тиску.
Температура замерзання рідини – це температура, за якої тиск насиченої пари цієї рідини над її рідкою фазою стає таким, що дорівнює тиску пари над її твердою фазою.
 Р В Д Р В Д
 А Н2О В1
А Н2О В1
 Е С розчин Е С розчин
  лід ∆ t зам. ∆ t кип. лід ∆ t зам. ∆ t кип.
tзам. ОоС 100оС t кип. tоС | АВ – крива тиску пари води (чистого розчинника) СД – крива тиску пари над розчином АЕ – крива тиску пари льоду 100оС – температура кипіння води tкип– температура кипіння розчину (Р пари води = Р пари розчину) т.В1 – тиск пари над розчином при 100оС (розчин ще не кипить) Р пари Н2О = Р пари розчину(t кип. розчину); tкип розчину > t кип Н2О |
ОоС – температура замерзання води;
т.С – тиск пари над розчином (розчин ще не замерзає);
Від тиску пари над розчином залежать:
| Ä температура кипіння розчину Р пари = Р зовнішній; Р пари Н2О = Р пари розчину | Ä температура замерзання розчину Р пари твердої речовини = Р пари рідини |
| Внаслідок зниження Р пари над розчином: | |
| tкип розчину > tкип розчинника | tзам розчину < tзам розчинника |
| Внаслідок збільшення концентрації розчиненої речовини: | |
∆tкип. = Кеб. С,
де Кеб. – ебуліоскопічна константа (підвищення температури кипіння розчину при розчиненні 1 моль речовини в 1000г розчинника);
∆tкип – підвищення температури кипіння розчину порівняно з чистим розчинником.
∆tкип = С,
де Кеб. – ебуліоскопічна константа (підвищення температури кипіння розчину при розчиненні 1 моль речовини в 1000г розчинника);
∆tкип – підвищення температури кипіння розчину порівняно з чистим розчинником.
∆tкип = 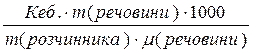 Кеб.(Н2О)=0,52
Кеб.(Н2О)=0,52
| ∆tзам. = Ккр.  С,
де Ккр. – кріоскопічна константа (зниження температури замерзання викликане розчиненням 1 моль речовини в 1000г розчинника);
∆tзам – зниження температури замерзання розчину порівняно з чистим розчинником.
∆tзам = С,
де Ккр. – кріоскопічна константа (зниження температури замерзання викликане розчиненням 1 моль речовини в 1000г розчинника);
∆tзам – зниження температури замерзання розчину порівняно з чистим розчинником.
∆tзам = 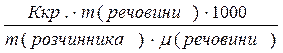 Ккр.(Н2О)=1,86
Ккр.(Н2О)=1,86
|
ІІ закон Рауля: зниження температури замерзання або збільшення температури кипіння розчинів пропорційне концентрації розчиненої речовини.
|
|
|
Визначення відносної молекулярної маси речовини за знаиженням температури замерзання його розчину методом Раста.
Як розчинник викорстовують камфору, яка має високе значення кріоскопічної сталої, в інших методах використовують оцтову кислоту або інші розчииники.
Для експериментального визначення зниження температури замерзання використовується спеціальний прилад, який складається: з стакану, заповненого охолоджувальною сумішшію, з внутрішньої градуйованої скляної пробірки, в яку вміщуюють відому масу розчинника. Розчинник повільно охолоджують, постійно помішуючи, щоб звести до мінімумму переохолодження. При цьому кожні півхвилини визначають температуру за допомогою термометра Бекмана. За показниками термометра будують криву охолодження, згідно якої визначають температуру замерзання. Потім розчинник нагрівають до плавлення і додадють до нього відому масу рочиненої речовини. Розчин перемішують до повного розчинення добавленої речовини. Потім розчин охолоджують, записуючи температуру кожні півхвилини, і визначають нову температуру замерзання розчину. Знаючи значення кріоскопічної сталої, роблять обчислення результатів:

Біологічні багатокомпонентні системи (молоко, кров) замерзають при температурі нижче 0 С. Клітини нативної м’язової тканини продукту та між м’язовий простір заповнені рідиною, в якій у різному колоїдному стані знаходяться білки, мінеральні та інші речовини.
|
|
|
При заморожуванні з води, що міститься у м’язових волокнах і міжм’язовому просторі, утворюється лід, який має більший об’єм, ніж вода. Тому лід викликає деструкцію та інші зміни м’язової тканини (риби, м’яса). При температурі від 0,5 до – 5 С утворюється максимальна кількість кристалів льоду, однак при цьому не вся вода замерзає; при ‑18 С замерзає 75% води; повністю розчин замерзає при – 56 С. Розмір кристалів льоду та їх місце утворення залежать від швидкості заморожування. При швидкому заморожуванні кристали утворюються в основному у середині клітин, із зменшенням швидкості заморожування – кристали утворюються у міжклітинному просторі. При цьому волокна зневоднюються і між ними виникають порожнини.
Розміри кристалів обернено пропорційні швидкості заморожування. При повільному заморожуванні утворюється незначна кількість кристалів крупного розміру (ширина 5·10-4см, довжина 1·10-2см) і значно пошкоджують м’язову тканину. При швидкому заморожуванні утворюється значна кількість дрібних кристалів (ширина 5·10-6см, довжина 1·10-4см), які менше пошкоджують м’язову тканину.
Із збільшенням тривалості заморожування в продуктах збільшуються структурні зміни: при тривалому заморожуванні (понад 5хв.) сарколема (клітинна плазма) пошкоджується, і кристали льоду утворюються спочатку всередині волокон, а потім ззовні. При незначному пошкодженні сарколеми м’язи можна розморозити без втрати соку. При цьому вода, утворена при таненні льоду, повністю поглинається білками.
У промислових умовах швидкість заморожування нижче тієї, що спричиняє внутрішньоклітинне утворення льоду. При такій швидкості кристали льоду спочатку утворюються ззовні волокон, оскільки осмотичний тиск у міжклітинному просторі менше, ніж у середині клітини. При зовнішньоклітинному утворенні льоду іонна сила незамороженої внутрішньоклітинної рідини збільшується і вода осмотично видаляється із переохолодженої внутрішньої частини м’язових клітин. Виділена вода намерзає на кристали льоду і збільшує їх, в результаті чого волокна деформуються і руйнуються. Більш того, при високій іонній силі відбувається денатурація частини м’язових білків, що зменшує вологозв’язуючу здатність м’язових білків і нездатність волокон після відтанення поглинати воду, видалену при заморожуванні.
|
|
|

|
|
|
|
Дата добавления: 2013-12-14; Просмотров: 731; Нарушение авторских прав?; Мы поможем в написании вашей работы!
