
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Условия равновесия фаз. Фазовые диаграммы
|
|
|
|
Опыт показывает, что одно и то же однородное вещество в зависимости от внешних условий может находиться в различных состояниях, т.е. иметь разные макроскопические свойства (например: плотность, вязкость, проводимость и т.д.), и наоборот, при заданных внешних условиях в тепловом равновесии вещество может существовать не как однородное тело, а распадаться на две или более соприкасающиеся однородные части, находящиеся в различных макроскопических состояниях. Такие состояния называются фазовыми состояниями вещества. С точки зрения термодинамики фазой называется всякая однородная система, макроскопические свойства которой во всех точках одинаковы.
Фазой называется макроскопическая физически однородная часть вещества, отделенная от других частей системы границами раздела, так что она может быть извлечена из системы механическим путем.
Понятно, что в системе может быть несколько твердых или жидких (вода и ртуть) фаз, но она не может содержать более одной газовой фазы, поскольку все газы необратимо смешиваются между собой.
Примерами таких состояний могут быть агрегатные состояния вещества – газообразное, жидкое, твердое, однородные состояния, отличающиеся химическим составом, различные аморфные и кристаллические модификации твердого тела. Понятие фазового состояния намного шире, чем понятие агрегатного состояния вещества. Можно сказать, что фазовое состояние - это понятие, основанное на различии в характере структурной организации вещества на молекулярном уровне. Например, полиморфные кристаллические модификации определенного вещества являются различными фазовыми состояниями, которые отличаются характером взаимного расположения атомов и молекул. Строго говоря, понятие агрегатного состояния не является точно определенным. Можно сказать, что агрегатное – газовое, жидкое и твердое состояния вещества в первую очередь различаются характером теплового движения атомов и молекул.
|
|
|
Важнейшим вопросом в учении о фазах является выяснение условий, при которых система, состоящая из двух или более фаз, находится в равновесии. Понятие равновесия многофазной системы включает в себя механическое равновесие и тепловое равновесие. Для теплового равновесия необходимо, чтобы все фазы системы имели одну и ту же температуру. Необходимым условием механического равновесия является равенство давлений по разные стороны границы раздела соприкасающихся фаз. Это условие справедливо для случая плоских границ раздела. Для кривых границ оно нарушается действием сил поверхностного напряжения. В некоторых случаях равенство давлений и температур еще не означает, что система находится в равновесии, так как соприкасающиеся фазы могут превращаться друг в друга. Такие превращения называются фазовыми превращениями. В этом случае одни фазы растут, другие уменьшаются и могут совсем исчезнуть. Состояние равновесия должно означать, что массы всех фаз остаются неизменными во времени. Однако следует иметь в виду, что состояние равновесия не является статическим. Оно статистическое или динамическое. Это означает, что количество вещества в каждой фазе только в среднем остается неизменным (динамическое равновесие между жидкостью и ее насыщенным паром).
Условие равновесия фаз для химически однородных веществ можно вывести их теорем термодинамики. Если в условиях фазового равновесия температура и давление остаются неизменными, то термодинамический потенциал  = U - TS + pV системы может только убывать. При равновесии он принимает минимальное значение, что можно положить в основу определения условия равновесия.
= U - TS + pV системы может только убывать. При равновесии он принимает минимальное значение, что можно положить в основу определения условия равновесия.
|
|
|
Рассмотрим систему состоящую из двух фаз 1 и 2, которые могут превращаться друг в друга. Пусть m1 – масса первой, а m2 - масса второй фазы. Обозначим через 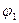 и
и 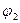 у дельные термодинамические потенциалы вещества в этих фазах. Тогда термодинамический потенциал всей системы будет:
у дельные термодинамические потенциалы вещества в этих фазах. Тогда термодинамический потенциал всей системы будет:  . Поскольку удельные термодинамические потенциалы являются однозначными функциями только давления и температуры, то при постоянстве последних
. Поскольку удельные термодинамические потенциалы являются однозначными функциями только давления и температуры, то при постоянстве последних 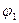 и
и 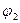 меняться не будут. Не изменяется и полная масса системы, равная m=m1+m2. Могут изменяться только массы фаз, но эти изменения должны происходить в направлении уменьшения термодинамического потенциала системы
меняться не будут. Не изменяется и полная масса системы, равная m=m1+m2. Могут изменяться только массы фаз, но эти изменения должны происходить в направлении уменьшения термодинамического потенциала системы  . Если
. Если 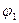 >
> 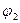 , то всякое превращение фазы 1 в фазу 2 будет сопровождаться уменьшением
, то всякое превращение фазы 1 в фазу 2 будет сопровождаться уменьшением  . Это превращение будет происходить до тех пор, пока вся фаза 1 не превратиться в более устойчивую фазу 2. Система сделается однородной и ее термодинамический потенциал примет минимальное значение
. Это превращение будет происходить до тех пор, пока вся фаза 1 не превратиться в более устойчивую фазу 2. Система сделается однородной и ее термодинамический потенциал примет минимальное значение 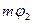 . Если
. Если 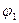 <
< 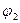 , то произойдет обратный процесс. И только при условии:
, то произойдет обратный процесс. И только при условии:

фазы будут находиться в равновесии друг с другом.
Таким образом, условием равновесия фаз является равенство их удельных термодинамических потенциалов.
Следует отметить, что поскольку внутренняя энергия и энтропия системы определены с точностью до произвольной линейной функции температуры, то и термодинамический потенциал системы и удельные термодинамические потенциалы отдельных фаз имеют ту же неопределенность. Для исключения этой неопределенности достаточно условиться определять удельные термодинамические потенциалы путем интегрирования выражения  из одного и того же исходного состояния.
из одного и того же исходного состояния.
Смысл условия  состоит в том, что при любых фазовых превращениях величина удельного термодинамического потенциала остается неизменной. Следовательно, при всех изменения состояния вещества его удельный термодинамический потенциал всегда изменяется непрерывно. В этом отношении он отличается от других физических величин: удельного объема, удельной энтропии, теплоемкости и пр., которые при фазовых превращениях, как правило, меняются скачкообразно.
состоит в том, что при любых фазовых превращениях величина удельного термодинамического потенциала остается неизменной. Следовательно, при всех изменения состояния вещества его удельный термодинамический потенциал всегда изменяется непрерывно. В этом отношении он отличается от других физических величин: удельного объема, удельной энтропии, теплоемкости и пр., которые при фазовых превращениях, как правило, меняются скачкообразно.
Т.о. две фазы могут находиться в равновесии только при таких значениях температуры и давления, которые удовлетворяют уравнению  . При изменении давления меняется температура сосуществования фаз. Эту зависимость P = P(T) можно изобразить графически на диаграмме фазовых состояний.
. При изменении давления меняется температура сосуществования фаз. Эту зависимость P = P(T) можно изобразить графически на диаграмме фазовых состояний.
|
|
|
 На рис.100 показан пример такой диаграммы, изображенной в координатах P,T.
На рис.100 показан пример такой диаграммы, изображенной в координатах P,T.
Кривая 1, определяемая равенством химических потенциалов жидкой и газообразной фаз, разделяет на фазовой диаграмме области существования жидкой и газообразной фаз. Аналогично кривые 2 и 3 соответствуют равновесию жидкость - твердая фаза и газ - твердая фаза. Общая точка всех трех линий равновесия называется тройной точкой. В этой точке одновременно могут существовать все три фазы. Так как три фазы вещества могут одновременно находиться в равновесии только при определенном значении температуры, то тройные точки являются удобным стандартом для температурной шкалы. Для их воспроизведения не нужно заботиться о поддержании определенного давления, как это требуется, например, при выборе в качестве стандартной точки температуры плавления льда. Как уже говорилось, в качестве стандарта для определения абсолютной температурной шкалы выбрана тройная точка воды, равная 273,16 К.
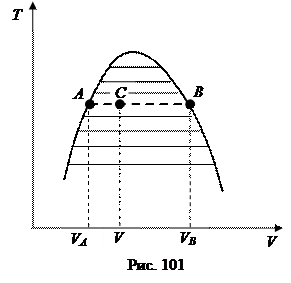 Фазовую диаграмму можно изобразить и в других координатах - T,V или P,V, где V - объем занимаемый определенным количеством вещества (например, молярный объем). На таких диаграммах все состояния, в которых сосуществуют две фазы, в отличие от P,T -диаграмм, заполняет целую область плоскости. Это связано с тем, что двухфазные равновесные системы всегда имеют одинаковые температуры и давления, в то время как удельные объемы этих фаз различаются. На рис.101 показан пример T,V -диаграммы газ-жидкость. Заштрихованная область соответствует двухфазным состояниям, когда одновременно сосуществуют жидкая и газообразная фазы.
Фазовую диаграмму можно изобразить и в других координатах - T,V или P,V, где V - объем занимаемый определенным количеством вещества (например, молярный объем). На таких диаграммах все состояния, в которых сосуществуют две фазы, в отличие от P,T -диаграмм, заполняет целую область плоскости. Это связано с тем, что двухфазные равновесные системы всегда имеют одинаковые температуры и давления, в то время как удельные объемы этих фаз различаются. На рис.101 показан пример T,V -диаграммы газ-жидкость. Заштрихованная область соответствует двухфазным состояниям, когда одновременно сосуществуют жидкая и газообразная фазы.
Аналогичным образом выглядит фазовая диаграмма в координатах P,V.
Каждое фазовое превращение сопровождается скачкообразными изменениями каких-либо величин, характеризующих свойства вещества. Удельный термодинамический потенциал 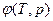 остается непрерывным при любых превращениях. Однако его производные могут испытывать разрыв непрерывности.
остается непрерывным при любых превращениях. Однако его производные могут испытывать разрыв непрерывности.
|
|
|
Фазовые превращения, при которых первые производные функции 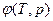 меняются скачкообразно, называются фазовыми превращениями первого рода.
меняются скачкообразно, называются фазовыми превращениями первого рода.
Фазовые превращения, при которых первые производные той же функции остаются неизменными, а вторые производные меняются скачкообразно, называются фазовыми превращениями второго рода.
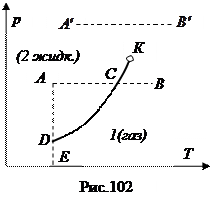 Рассмотрим более подробно фазовые диаграммы, которые являются следствием условия равновесия фаз
Рассмотрим более подробно фазовые диаграммы, которые являются следствием условия равновесия фаз  . Ради определенности будем рассматривать равновесие газ – жидкость (испарение – конденсация), хотя все результаты могут быть отнесены без изменений к другим фазовым превращениям. Состояние вещества изображается точкой на плоскости (Т,р) см. рис. 102. Каждая точка этой плоскости соответствует однородному (однофазному) состоянию вещества, либо жидкости, либо газу. Исключение составляют точки линии DK. Эта линия представляется уравнением
. Ради определенности будем рассматривать равновесие газ – жидкость (испарение – конденсация), хотя все результаты могут быть отнесены без изменений к другим фазовым превращениям. Состояние вещества изображается точкой на плоскости (Т,р) см. рис. 102. Каждая точка этой плоскости соответствует однородному (однофазному) состоянию вещества, либо жидкости, либо газу. Исключение составляют точки линии DK. Эта линия представляется уравнением  . На ней удельные термодинамические потенциалы жидкости и пара одинаковы, следовательно, каждая точка этой линии изображает либо жидкость, либо ее пар, либо равновесную смесь этих фаз в любых пропорциях. Если разрешить уравнение
. На ней удельные термодинамические потенциалы жидкости и пара одинаковы, следовательно, каждая точка этой линии изображает либо жидкость, либо ее пар, либо равновесную смесь этих фаз в любых пропорциях. Если разрешить уравнение  относительно р, то уравнение кривой DK представится в виде р=р(Т). Это уравнение дает зависимость давления насыщенного пара от температуры. Кривая DK в этом случае будет называться кривой равновесия жидкости и ее насыщенного пара или кривой испарения. Пересечем кривую испарения изобарой АВ ниже критической точки К. В точке А вещество находится в жидком состоянии поскольку давление, равное р=ЕА выше давления насыщенного пара р=ЕD при той же температуре. Под таким давлением пар существовать не может, он сконденсируется в жидкость. При нагревании жидкости под постоянным давлением изображающая точка перемещается вправо. В точке С начнется испарение жидкости. Во все время испарения температура жидкости и ее насыщенного пара будет оставаться постоянной. Когда вся жидкость испарится, изображающая точка при дальнейшем нагревании при постоянном объеме будет перемещаться вдоль отрезка изобары СВ, что соответствует нагреванию пара при постоянном давлении. Из этого следует, что точки, лежащие левее кривой DK изображают жидкое состояние, правее – газообразное. Точка К – критическая. Следствием того, что кривая испарения обрывается (заканчивается) критической точкой является непрерывность жидкого и газообразного состояний.
относительно р, то уравнение кривой DK представится в виде р=р(Т). Это уравнение дает зависимость давления насыщенного пара от температуры. Кривая DK в этом случае будет называться кривой равновесия жидкости и ее насыщенного пара или кривой испарения. Пересечем кривую испарения изобарой АВ ниже критической точки К. В точке А вещество находится в жидком состоянии поскольку давление, равное р=ЕА выше давления насыщенного пара р=ЕD при той же температуре. Под таким давлением пар существовать не может, он сконденсируется в жидкость. При нагревании жидкости под постоянным давлением изображающая точка перемещается вправо. В точке С начнется испарение жидкости. Во все время испарения температура жидкости и ее насыщенного пара будет оставаться постоянной. Когда вся жидкость испарится, изображающая точка при дальнейшем нагревании при постоянном объеме будет перемещаться вдоль отрезка изобары СВ, что соответствует нагреванию пара при постоянном давлении. Из этого следует, что точки, лежащие левее кривой DK изображают жидкое состояние, правее – газообразное. Точка К – критическая. Следствием того, что кривая испарения обрывается (заканчивается) критической точкой является непрерывность жидкого и газообразного состояний.
Если вычислить производную давления насыщенного пара по температуре  , то определиться наклон кривой испарения. Учитывая, что вдоль кривой р=р(Т)
, то определиться наклон кривой испарения. Учитывая, что вдоль кривой р=р(Т) 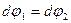 , а
, а  , можно записать:
, можно записать:
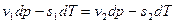 или
или 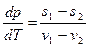
где s1, v1, s2, v2 - удельные энтропии и удельные объемы пара и жидкости.
Фазовые превращения сопровождаются скачкообразными измерениями энтропии. Это означает, что при таких превращениях выделяется или поглощается тепло  . Предполагается, что переход совершается квазистатически, при постоянной температуре, а, следовательно, - при постоянном давлении.
. Предполагается, что переход совершается квазистатически, при постоянной температуре, а, следовательно, - при постоянном давлении.
Тепло q называется удельной теплотой фазового превращения. Если q ввести в последнее уравнение, то получится известное уравнение Клапейрона-Клаузиуса:
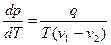
В случае испарения жидкости затрата тепла требуется по следующим причинам. Скорости молекул жидкости распределены по закону Максвелла. Покинуть жидкость могут только быстрые молекулы, так как они способны преодолеть силы притяжения, действующие в поверхностном слое. Проходя через него, молекулы замедляются так, что температура пара оказывается равной температуре жидкости. В результате ухода быстрых молекул жидкость охлаждается. Для поддержания постоянной температуры жидкости требуется подвод тепла. Теплота перехода наблюдается и в других фазовых превращениях, однако механизм этого явления сложнее, чем в случае испарения.
Рассмотренный случай испарение – конденсация относится к фазовым превращениям первого рода. Рассмотрим их более подробно. При анализе термодинамических потенциалов были выведены соотношения:

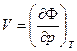 или в удельных величинах:
или в удельных величинах: 
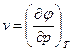
По определению фазовые переходы первого рода сопровождаются скачкообразным изменением первых производных термодинамического потенциала. Следовательно, при таких превращениях должны наблюдаться скачки либо удельной энтропии, либо удельного объема, либо обеих величин одновременно. (Известно, что удельный объем насыщенного пара на порядки выше удельного объема жидкости, а это и означает, что при переходе от жидкости к пару наблюдается скачок удельного объема, т.е. не существует промежуточных значений удельных объемов.)
Скачкообразное изменение удельной энтропии означает, что при фазовом превращении первого рода происходит либо поглощение, либо выделение тепла. Это явление наблюдается при превращениях: твердое тело – жидкость (теплота плавления или кристаллизации), твердое тело – газ (теплота сублимации), жидкость – пар (теплота парообразования или конденсации). Количество тепла, которое надо сообщить единице массы вещества, для того, чтобы перевести его из состояния 1 в состояние 2, определяется выражением:  .
.
Рассмотрим фазовые превращения второго рода. Из определения следует, что при таких превращениях величины удельной энтропии и удельного объема остаются постоянными. Однако должны претерпевать разрыв некоторые или все вторые производные термодинамического потенциала.
Для каждой фазы в отдельности эти производные непрерывны и представляются выражениями:
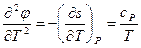


Но они претерпевают разрыв при фазовых превращениях второго рода. Скачком изменяется одна или несколько из следующих величин:
1) удельная теплоемкость ср..
2) коэффициент теплового расширения 
3) изотермический коэффициент сжатия 
 К фазовым превращениям второго рода относятся, например, превращение железа, никеля, кобальта или какого-либо магнитного сплава из ферромагнитного в парамагнитное состояние. Оно происходит при нагревании при определенной температуре, называемой точкой Кюри. Аналогичные фазовые превращения, при которых меняются диэлектрические свойства вещества, испытывают при нагревании и охлаждении сегнетова соль (двойная натриево-калиевая соль винной кислоты) и другие сегнетоэлектрики. Температура превращения в них также называется точкой Кюри. Фазовые превращения второго рода испытывают многие металлы и сплавы при переходе в сверхпроводящее состояние. Примером фазового превращения второго рода является также переход жидкого гелия 1 в его другую жидкую модификацию – гелий 2. Фазовая диаграмма гелия представлена на рис. 103.
К фазовым превращениям второго рода относятся, например, превращение железа, никеля, кобальта или какого-либо магнитного сплава из ферромагнитного в парамагнитное состояние. Оно происходит при нагревании при определенной температуре, называемой точкой Кюри. Аналогичные фазовые превращения, при которых меняются диэлектрические свойства вещества, испытывают при нагревании и охлаждении сегнетова соль (двойная натриево-калиевая соль винной кислоты) и другие сегнетоэлектрики. Температура превращения в них также называется точкой Кюри. Фазовые превращения второго рода испытывают многие металлы и сплавы при переходе в сверхпроводящее состояние. Примером фазового превращения второго рода является также переход жидкого гелия 1 в его другую жидкую модификацию – гелий 2. Фазовая диаграмма гелия представлена на рис. 103.
Гелий может существовать в газообразной, двух жидких и твердой модификациях. Характерной особенностью диаграммы состояния гелия является отсутствие на ней кривой возгонки. Если охлаждать жидкий гелий 1, то при определенной температуре, зависящей от внешнего давления и называемой l-точкой, он испытывает фазовое превращение и переходит в жидкий гелий 2.
Эта жидкая модификация остается жидкой вплоть до температуры абсолютного нуля. Таким свойством обладает только гелий. Все прочие вещества при температуре абсолютного нуля могут находиться только в твердом состоянии.
Жидкий гелий 2 обладает уникальным свойством сверхтекучести. (Открыто П.Л.Капицей). Гелий 2 не имеет вязкости, для него она равна нулю.
В случае фазовых переходов второго рода уравнение Клапейрона – Клаузиуса теряет смысл, поскольку его правая часть 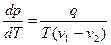 обращается в неопределенность типа 0/0. Поэтому при рассмотрении фазовых превращений второго рода пользуются соотношениями Эренфеста, которые являются следствием непрерывности удельной энтропии и удельного объема при фазовых превращениях второго рода.
обращается в неопределенность типа 0/0. Поэтому при рассмотрении фазовых превращений второго рода пользуются соотношениями Эренфеста, которые являются следствием непрерывности удельной энтропии и удельного объема при фазовых превращениях второго рода.
Если рассматривать удельную энтропию какой-либо фазы как функцию температуры и давления  , то для ее дифференциала можно записать:
, то для ее дифференциала можно записать:
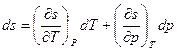
Поскольку  (исходя из определения удельной теплоемкости), а
(исходя из определения удельной теплоемкости), а 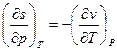 (см. соотношения Максвелла), то:
(см. соотношения Максвелла), то:
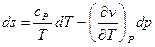
Если записать это соотношение для двух разных фаз:

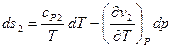
учесть, что на линии равновесия (ввиду непрерывности удельной энтропии при фазовых превращениях второго рода)  и вычесть первое уравнение из второго, то получим:
и вычесть первое уравнение из второго, то получим:

Или сокращенно:
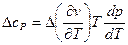
Это первое соотношение Эренфеста, где  и
и 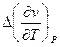 обозначают скачки, испытываемые этими величинами при фазовых превращениях второго рода.
обозначают скачки, испытываемые этими величинами при фазовых превращениях второго рода.
Если рассматривать удельную энтропию как функцию температуры и удельного объема  , то аналогичным образом можно вывести второе соотношение Эренфеста:
, то аналогичным образом можно вывести второе соотношение Эренфеста:

Третье соотношение Эренфеста получается также из условия непрерывности энтропии, но рассматриваемой как функцию удельного объема и давления  . Оно записывается в виде:
. Оно записывается в виде:

Четвертое соотношение выводиться из условия непрерывности удельного объема, рассматриваемого как функцию температуры и давления 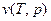 . Оно имеет вид:
. Оно имеет вид:

Производные 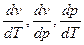 в соотношениях Эренфеста берутся вдоль соответствующих кривых равновесия.
в соотношениях Эренфеста берутся вдоль соответствующих кривых равновесия.
Следует отметить, что классификация фазовых переходов по Эренфесту и основанная на ней термодинамическая теория имеют ограниченную область применимости. Это связано с тем, что в теории Эренфеста требуется, чтобы вторые производные термодинамического потенциала в точках фазовых превращений были конечными. Однако, как показали эксперименты, это не всегда соблюдается. Поэтому были разработаны другие теории, в частности, теория фазовых переходов второго рода Ландау.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 4479; Нарушение авторских прав?; Мы поможем в написании вашей работы!