
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Константа дисоціації
Оскільки електролітична дисоціація слабких електролітів є оборотним процесом, то вона підкоряється закону діючих мас. Тому для загальної реакції електролітичної дисоціації слабкого електроліту
Ktx Any Û xKty+ + yAnx–
константа рівноваги матиме вигляд:
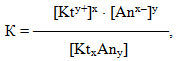
де [Kty+] і [Anx–] – молярні концентрації відповідно катіонів і аніонів, а [KtxAny] – молярна концентрація недисоційованих молекул. Нагадаємо, що за допомогою квадратних дужок позначають молярну концентрацію речовини у рівноважному стані.
Константа рівноваги К слабкого електроліту називається константа дисоціації Кдис і характеризує здатність речовини розпадатися у розчині на йони.
Чим менше значення Кдис, тим слабкішим є електроліт, і навпаки, велике значення Кдис свідчить про його високу здатність до дисоціації.
Важливішою ознакою константи дисоціації є те, що вона не залежить від концентрації розчину, а залежить лише від природи розчиненої речовини і розчинника та від температури. Значення констант дисоціації наводяться у спеціальних довідниках.
Для електролітів, що дисоціюють ступінчасто, кожній стадії дисоціації відповідає своє значення константи дисоціації. Наприклад, для ортофосфатної кислоти:

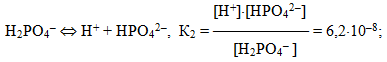
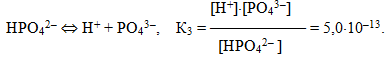
Для загального процесу:
Н3РО4 Û 3Н+ + РО43–
сумарна константа дисоціації
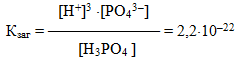
дорівнює добутку ступінчастих констант дисоціації:
Кзаг = К1×К2×К3 = 7,1× 10–3 × 6,2 × 10–8 × 5,0 × 10–13 =2,2 × 10–22.
При цьому К1 > К2 > К3, оскільки відщеплення йона Н+ від нейтральної молекули відбувається значно легше, ніж від однозарядного негативного аніона Н2РО4–, тим більше, від двохзарядного негативного аніона НРО42–. З цього випливає, що Н3РО4 є значно сильнішою кислотою, ніж Н2РО4–, а Н2РО4–, у свою чергу, – ніж НРО42–.
Багатокислотні гідроксиди теж дисоціюють ступінчасто, наприклад:

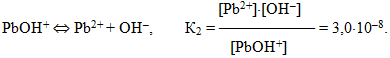
|
Дата добавления: 2014-01-04; Просмотров: 1886; Нарушение авторских прав?; Мы поможем в написании вашей работы!