
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Каталитические процессы
|
|
|
|
Лекция 9.
Каталитические процессы – это процессы, в которых под влиянием веществ, называемых катализаторами, изменяется механизм реакции и реакция идет по энергетически более выгодному пути.
Назначение катализатора:
− ускорять реакции;
− изменять диапазон температур;
− изменять состав продуктов реакции.
Сущность каталитического процесса:
1) Снижается энергия активации, Е;
2) Реакция протекает через ряд элементарных стадий;
3) Равновесие не смещается, а ускоряется его достижение;
4) Энергетический уровень молекул не изменяется.
Ход реакции на энергетической диаграмме (рис. 9.1) изображен кривой 1. В присутствии катализатора механизм реакции изменяется, она протекает через несколько последовательных элементарных стадий (кривая 2). Каждая из этих последовательных стадий характеризуется своими значениями энергии активации, но, как правило, высота каждого из этих потенциальных барьеров ниже энергии активации Ео.
Чем меньше Е, тем больше скорость реакции.
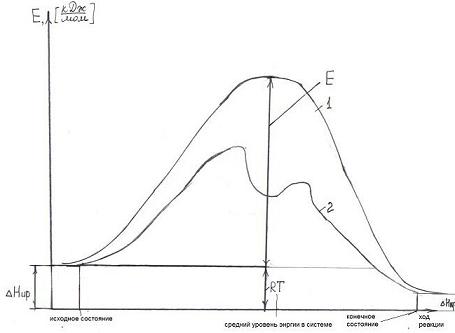
Рис. 9.1. Энергетические диаграммы каталитической и некаталитической реакций.
Реакции, в которых катализаторами являются исходные вещества или продукты реакции,называются автокатализатические реакции.
Есть гомогенный и гетерогенный катализ.
Гомогенный катализ:
− газофазный, очень редкий;
− жидкофазный, широко распространен в природе (синтез белков, обмен веществ).
биокатализаторы – ферменты, энзимы и др.

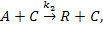
где С – катализатор.

После интегрирования получаем:
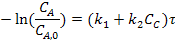
Состав катализатора:
1) Носитель (пористое вещество);
2) Сам катализатор;
3) Активатор или промотор – это вещество, которое не участвует в реакции, а повышает активность катализатора.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 5385; Нарушение авторских прав?; Мы поможем в написании вашей работы!