
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общая характеристика d-элементов VIIБ-группы
|
|
|
|
 Марганец Мn, технеций Тс и рений Rе — элементы-аналоги, образующие группу VIIБ.
Марганец Мn, технеций Тс и рений Rе — элементы-аналоги, образующие группу VIIБ.
Из элементов этой группы наиболее распространен в природе марганец. Технеций — радиоактивный элемент, в природе практически не встречается, получен искусственным путем. Рений в земной коре содержится в незначительном количестве. Он относится к редким и рассеянным элементам.
Валентные электроны элементов VIIБ-группы [конфигурация (n-1)d5ns2] располагаются на энергетических уровнях следующим образом:
 Для марганца характерны степени окисления +2, +3, +4, -1-6, +7. Для остальных элементов этой группы известны только степени окисления +4 и +7.
Для марганца характерны степени окисления +2, +3, +4, -1-6, +7. Для остальных элементов этой группы известны только степени окисления +4 и +7.
Подобно другим d-элементам, соединения VIIБ-группы в низших степенях окисления проявляют восстановительные свойства, об основных свойствах этих соединений целесообразно говорить только применительно к соединениям марганца, который в растворах существует в виде катионов Мn2+ и Мn3+.
В высших степенях окисления элементы VIIБ-группы существуют в анионной форме (МnО4-, ТеО4-, RеО4-), проявляя окислительные и кислотные свойства. Для RеO2 преобладают кислотные свойства.
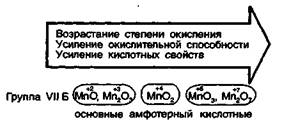 В промежуточной степени окисления (IV) явно выраженная амфотерность проявляется у марганца. Это может быть объяснено уменьшением устойчивости элементов с увеличением порядкового номера, что приводит к ослаблению дифференциации кислотно-основных признаков в промежуточных степенях окисления. Поэтому именно у соединений марганца отчетливо прослеживается отмечаемая закономерность изменения кислотно-основных и окислительно-восстановительных свойств.
В промежуточной степени окисления (IV) явно выраженная амфотерность проявляется у марганца. Это может быть объяснено уменьшением устойчивости элементов с увеличением порядкового номера, что приводит к ослаблению дифференциации кислотно-основных признаков в промежуточных степенях окисления. Поэтому именно у соединений марганца отчетливо прослеживается отмечаемая закономерность изменения кислотно-основных и окислительно-восстановительных свойств.
Реакционная способность элементных веществ VIIБ-группы уменьшается в ряду Мn—Тс—Rе. Без нагревания порошки Мn, Тс и Rе окисляются во влажном воздухе, превращаясь в МnО, ТеО, НRеО4. При нагревании эти металлы реагируют с О2, F2, Сl2, S, Р, Si.
|
|
|
Распространенность в земной коре: Мn — 0,09%; Тс — нет; Rе — 10-7%.
Эти элементы относятся к тяжелым металлам. Наиболее изучен марганец и его соединения.
При взаимодействии марганца с разбавленными кислотами (особенно при нагревании) выделяется водород. Ион марганца Мn2+ в воде существует как аквакомплекс. Поэтому в молекулярно-ионном виде реакция запишется так:
Мn + 2Н+ + 6Н2O → [Мn(Н2O)6]2+ + Н2↑
Химические свойства соединений марганца. Устойчивые степени окисления марганца +2, +4, +7 в соединениях кислородного и солевого характера. В медицинской практике используются соединения марганца(II) и марганца(VII).
Оксид марганца (II) МnО встречается в природе в виде мелких зеленых кристаллов, плохо растворимых в воде. При нагревании на воздухе превращается в разные оксиды:
6МnО + 3O2 → 6МnО2 + 3/2 О2 → 3Мn2О3 +4,5 О2 1000°С→ 6МnО3
Оксид марганца (II) растворяется в кислотах:
МnО + 2Н+ + 5Н2О → [Мn(Н2О)6]2+
Обработка аквакомплекса [Мn(Н2О)6]2+ при рН = 8,5 в атмосфере водорода приводит к образованию нерастворимого гидроксида марганца (II):
[Мn(Н2О)6]2+ + 2ОН- → Мn(OH)2↓ + 6Н2О
гидроксид марганца (II) обладает слабоосновными свойствами, окисляется кислородом воздуха и другими окислителями до марганцеватистой кислоты или ее солей манганитов:
Мn(ОН)2 + Н2О2 → Н2МnО3↓ + Н2О
марганцеватистая кислота
(бурый осадок)
В щелочной среде Мn2+ окисляется до МnО42-, а в кислой до МnО4-:
МnSО4 + 2КNО3 + 4КОН → К2МnО4 + 2КNО2 + К2SО4 + 2Н2О
Образуются соли марганцовистой Н2МnО4 и марганцовой НМnО4 кислот.
Если в опыте in vitro Мn2+ проявляет восстановительные свойства, то in vivo восстановительные свойства Мn2+ слабо выражены. В биологических процессах он не меняет степени окисления. Устойчивые биокомплексы Мn2+ in vivo стабилизируют эту степень окисления. Стабилизирующее влияние появляется в большом времени удержания гидратной оболочки. Для Мn2+ это время равно 100 мкс, тогда как для гидрофильного иона Na+ оно составляет 1 мкс.
|
|
|
Оксид марганца (IV) МnО2 является устойчивым природным соединением марганца, которое встречается в четырех модификациях. Все модификации имеют амфотерный характер и обладают окислительно-восстановительной двойственностью.
Примеры окислительно-восстановительной двойственности МnО2:
МnО2 + 2КI + 3СО2 + Н2О → I2 + МnСО3 + 2КНСО3
6МnО2 + 2NH3 → 3Мn2О3 + N2 + 3Н2О
4МnО2 + 3О2 + 4КОН → 4КМnО4 + 2Н2О
2МnО2 + 3Сl2 + 8КОН → 2КМnО4 + 6КСl + 4Н2О
Последняя реакция ставит под сомнение расхожее утверждение, что МnО2 в щелочной среде превращается в манганат — соль Мn (VI), а в кислой — в перманганат — соль Мn (VII). Кроме среды на окислительно-восстановительную способность влияют концентрация и потенциал окислителя.
Соединения Мn (VI) — неустойчивы. В растворах могут превращаться в соединения Мn (II), Мn (IV) и Мn (VII): оксид марганца (VI) МnО3 — темно-красная масса, вызывающая кашель. Гидратная форма МnО3 — слабая марганцовистая кислота Н2МnO4, которая существует только в водном растворе. Ее соли (манганаты) легко разрушаются в результате гидролиза и при нагревании. При 50°С МnО3 разлагается:
2МnО3 → 2МnО2 + О2
и гидролизуется при растворении в воде:
3МnО3 + Н2О → МnО2 + 2НМnО4
Производные Мn(VII) — это оксид марганца (VII) Мn2О7 и его гидратная форма – кислота НМnО4, известная только в растворе. Мn2О7 устойчив до 10°С, разлагается со взрывом:
Мn2О7 → 2МnО2 + О3
При растворении в холодной воде образуется кислота
Мn2O7 + Н2О → 2НМnО4
Соли марганцевой кислоты НМnО4 — перманганаты. Ионы обусловливают фиолетовую окраску растворов. Образуют кристаллогидраты типа ЭМnО4∙nН2О, где n = 3-6, Э = Li, Nа, Мg, Са, Sr.
Перманганат КМnО4 хорошо растворим в воде. Перманганаты — сильные окислители. Это свойство используется в медицинской практике для дезинфекции, в фармакопейном анализе для идентификации Н2О2 путем взаимодействия с КМnО4 в кислой среде. Количественное содержание КМnО4 в препаратах Государственная фармакопея рекомендует определять иодометрически путем проведения реакции с КI в кислой среде.
Глубина превращения перманганата зависит от рН среды, в которой протекает реакция. При сравнении стандартных окислительно-восстановительных потенциалов видно, что наиболее сильные окислительные свойства перманганат-ион проявляет в кислой среде.
|
|
|
Вследствие высокой окислительной способности кислородные соединения марганца в высших степенях окисления в организме не существуют.
Для организма перманганаты являются ядами, их обезвреживание может происходить следующим образом:
2КМnO4 + 5Н2O2 + 6СН3СООН = 2Мn(СН3СОО)2 + 2СН3СООК + 8Н2О + 5O2
Для лечения острых отравлений перманганатом используется 3%-ный водный раствор Н2O2, подкисленный уксусной кислотой.
Калий перманганат окисляет органические вещества клеток тканей и микробов. При этом КМnО4 восстанавливается до МnО2. Оксид марганца (IV) может также взаимодействовать с белками, образуя комплекс бурого цвета.
Под действием перманганата калия КМnО4 белки окисляются и свертываются (коагулируют). На этом основано его применение в качестве наружного препарата, обладающего противомикробными и прижигающими свойствами. При этом его действие проявляется только на поверхности кожи и слизистых оболочек. Окислительные свойства водного раствора КМnО4 используют для обезвреживания токсичных органических веществ. В результате окисления образуются менее токсичные продукты. Например, наркотик морфин превращается в биологически малоактивный оксиморфин.
Калий перманганат применяют в титриметрическом анализе для определения содержания различных восстановителей (перманганатометрия).
Высокую окислительную способность перманганата используют в экологии для оценки загрязненности сточных вод (перманганатный метод). По количеству окисленного (обесцвеченного) перманганата определяют содержание органических примесей в воде.
Перманганатный метод (перманганатометрию) используют также в клинических лабораториях для определения содержания мочевой кислоты в крови.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 937; Нарушение авторских прав?; Мы поможем в написании вашей работы!