
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Получение, строение, свойства КДС
|
|
|
|
1857г, М.Фарадей получил коллоидный раствор золота и открыл
отличительный признак – сильное рассеяние света
Получение:
Ø диспергационные методы - путем дробления
(механического, УЗ, электрического, химического) более крупных частиц
Ø конденсационные методы:
- Физические (метод замены растворителя: сера в этаноле+вода, одеколон, духи +вода)
- Химические (реакции, в которых образуются труднорастворимые соединения)
Условия получения КДС химическим конденсационным методом:
-использование достаточно разбаленных растворов,
-небольшой избыток одного из реагирующих веществ
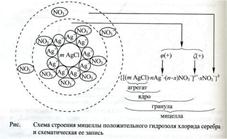
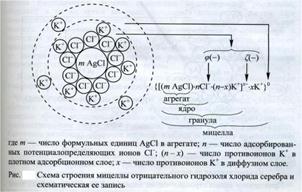
Структурная единица КДС – мицелла – (лат. «micella»-крошка, крупинка) нейтральная частица
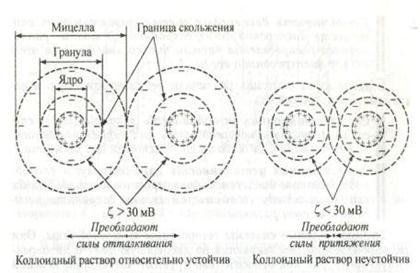
Коагулирующее действие (Дк)
Правило Шульца-Гарди: Строение мицеллы
Дк = А*z6




Коллигативные свойства – это свойства дисперсных систем, которые зависят от концентрации, величины и формы частиц, но не зависят от природы частиц дисперсной фазы
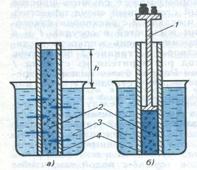
Осмос в дисперсных системах
• Осмос – это диффузия растворителя через полупроницаемую мембрану в раствор с большей концентрацией
• Осмотическое давление это величина гидравлического давления, которое необходимо приложить к раствору, чтобы осмос прекратился
Уравнение Вант-Гоффа:
π = C∙R∙T Для электролитов:
(для неэлектролитов) π = i∙C∙R∙T, i – изотонич. коэф-т
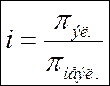 π – осмотическое давление, н/м2 (Па);
π – осмотическое давление, н/м2 (Па);
С– молярная концентрация, моль/л;
R– газовая постоянная(8,3Дж/моль∙К);
Т– температура, К.
|
 α – степень ионизации электролита
α – степень ионизации электролита
n – число частиц, которые образуются при ионизации
2- концентрированный раствор
3- растворитель
4- мембрана
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 4500; Нарушение авторских прав?; Мы поможем в написании вашей работы!