
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Типы кристаллических решеток. Структуры цеолитов
Классификация цеолитов
Все природные образования, составляющие предмет минералогии, так же как и все искусственные вещества в химии, необходимо делить прежде всего на две большие самостоятельные группы:
– неорганические минералы, к которым, кроме редко встречающихся самородных элементов, относятся природные соединения (за исключением органических) всех элементов, и
– органические минералы, представленные разнообразнейшими соединениями углерода (исключение составляют лишь карбонаты и карбиды, относимые к неорганическим соединениям).
Цеолиты относятся к неорганическим минералам, меньшая часть – к органическим.
Органические соединения, как известно, весьма существенно отличаются от неорганических соединений не только по химическим свойствам, но и по кристаллическому строению и природе связей между структурными единицами. Степень изученности этих групп минералов крайне не одинакова. В то время как наши знания по неорганическим минералам в настоящее время далеко продвинулись вперед, минералогия органических соединений находится еще в самой начальной стадии развития.
Классификация неорганических минералов построена на следующих принципах. Так как минералы в основном являются кристаллическими продуктами химических реакций, то для наших целей наиболее рациональной должна быть систематика их по химическому составу и кристаллической структуре. Именно с этими признаками связаны те важнейшие химические и физические свойства, по которым мы распознаем минералы.
Общая классификация неорганических минералов в схеме может быть представлена в следующем виде (без деления на группы):
Раздел I. Самородные элементы и интерметаллические соединения
Раздел II. Карбиды, нитриды и фосфиды*.
Раздел III. Сульфиды, сульфосоли и им подобные соединения.
1 класс. Простые и двойные сернистые и им подобные соединения.
2 класс. Сульфосоли.
Раздел IV. Галоидные соединения (галогениды).
1 класс. Фториды.
2 класс. Хлориды, бромиды и иодиды.
Раздел V. Окислы.
1 класс. Простые и сложные окислы.
2 класс. Гидроокислы.
Раздел VI. Кислородные соли.
1 класс. Иодаты*.
2 класс. Нитраты.
3 класс. Карбонаты.
4 класс. Сульфаты и селенаты.
5 класс. Хроматы.
6 класс. Молибдаты и вольфраматы.
7 класс. Фосфаты, арсенаты и ванадаты.
8 класс. Арсениты*.
9 класс. Бораты.
10 класс. Силикаты.
A. Силикаты с изолированными тетраэдрами аниона SiO4.
Б. Силикаты с изолированными группами тетраэдров SiO4.
B. Силикаты с непрерывными цепочками тетраэдров SiO4.
Г. Силикаты с непрерывными слоями тетраэдров SiO4.
Д. Силикаты с непрерывными трехмерными каркасами тетраэдров SiO4 и АlО4.
Цеолиты относятся к неорганическим минералам. Подкласс Д. Силикаты с непрерывными трехмерными каркасами тетраэдров (Si,Al)O4 в кристаллических структурах.
Соединения этого подкласса, с химической точки зрения, представляют собой почти исключительно алюмосиликаты, т. е. такие соединения, в кристаллических структурах которых участвуют анионные комплексы, состоящие не только из тетраэдров SiO4, но и из тетраэдров АlO4. При этом число ионов Si4+, замещенных ионами Аl3+, не превышает половины. Как правило, устанавливаются стехиометрические соотношения Si:Al, равные либо 3:1, либо 1:1, т. е. комплексные анионы чаще соответствуют следующим выражениям: Si3AlO8 или SiAlO4(Si2Al2O8).
По структурно-химической классификации цеолиты относятся к каркасным алюмосиликатам щелочных и щелочно-земельных элементов.
… По их химическому составу (система Грота).
1. Группа томсонита (комптонита). Относящиеся сюда цеолиты могут быть рассматриваемы как водные соли ортокремневой кислоты. Помимо относящегося сюда ромбического минерала томсонита, сюда принадлежит еще минерал гексагональной системы гидронефелит и целый ряд редких, мало изученных цеолитов.
2. Группа натролита. Цеолиты этой группы могут быть рассматриваемы, как основные соли метакремневой кислоты. Помимо описанного уже натролита, сюда принадлежат еще мезолит, сколецит, эдингтонит. Их взаимные химические отношения ясны из сопоставления их формул:
| Химическая формула | Кристаллическая система | |
| Натролит | [SiO3]3Al[AlO]Na2.2H2O | Ромбическая или моноклиническая |
| Мезолит | [SiO3]3 Al[АlО]Na2.2H2O | Моноклиническая |
| +[SiO3]3 Al[Аl.2ОH]Ca.2H2O | ||
| Сколецит | [SiO3]3Al[Al.2OH] Ca.2H2O | Моноклиническая |
| Эдингтонит | [SiO3]3Al[Al.2OH] Ba.2H2O | Ромбическая |
Из этого сопоставления видно, что по химическому составу мезолит представляет не что иное, как изоморфную смесь натролита и сколецита.
3. Группа анальцима; сюда относятся средние соли метакремневой кислоты. По своему химическому составу – [Si3O8][SiO4]Al2Na2 . 2H2O, следовательно, может быть рассматриваем как гидрат натрового лейцита, состав которого может быть выражен формулой [Si3O8][SiO4]Al2[K,Na]2, и с которым анальцим имеет и много общего по своему наружному виду.
4. Группа апофиллита, цеолиты – по химическому составу – кислые соли метакремневой кислоты. Кроме апофиллита, сюда принадлежат еще редкие минералы: фоязит, эпистильбит, брюстерит, гейландит. Химический состав – [SiO3]6Al2(Ca,Sr)H4 . 3H2O.
5. Группа инезита, редкого минерала триклинической системы.
6. Группа десмина, цеолиты, являющиеся нейтральными солями поликремневых кислот. Кроме описанных уже десмина, гармотома, сюда принадлежат еще изоморфный с гармотомом филиппсит (известковый гармотом, хрисианит), а кроме того, триклинические минералы (по внешности псевдотригональные) гмелинит и шабазит, и целый ряд более редких и мало изученных минералов.
7. Представитель последней группы цеолитов, ломонтит, является наиболее легко разрушающимся цеолитом и может быть рассматриваем как основная соль дикремневой кислоты H2Si2O5, так как он теряет остаток воды только при прокаливании.
По наличию общих структурных элементов, сходных каналоввыделяют 9 кристаллохимических групп цеолитов. Каркасы цеолитов группы анальцима построены четверными кольцами [Si, АlO4] тетраэдров. Из различных сочетаний четырёхчленных колец построены также каркасы цеолитов. группы ломонтита и филлипсита. Структуры цеолитов группы натролита образованы из цепочек, которые составлены из четырёхчленных колец, соединённых Друг с другом пятым тетраэдром. Характерные элементы цеолитов группы морденита и гейландитаклиноптилолита представлены пятерными петлями тетраэдров [Si, АlO4]. Одиночные шестерные кольца являются основой каркасов цеолитов группы эрионита, двойные – шабазита и фожазита.
Микроскопически (по габитусу) выделяют:
– волокнистые цеолиты – натролит, мезолит, томсонит, сколецит, ломонтит, гоннардит, эдингтонит, морденит, эрионит, жисмондин (абразит), феррьерит и другие;
– листоватые цеолиты (или пластинчатые) – стильбит, гейландит, брюстерит и другие;
– изометрические цеолиты – шабазит, филлипсит, гармотом, фоязит, гмелинит, дакиардит и другие.
Габитус, хабитус (лат. habitus – внешность, наружность), внешний облик человека, его телосложение, конституция, осанка; наружный вид, облик животного или растительного организма, кристалла, минерала.
По происхождению цеолиты — гидротермальные, экзогенные, реже метаморфические минералы
Классификация цеолитов Баррера по молярно-ситовому действию, показывает, какие молекулы по своим размерам могут адсорбироваться цеолитами того или иного типа. Классификация по структурному принципу была предложена Смитом, а позднее Мейером.
Более 50 лет назад в промышленных лабораториях США, СССР и Великобритании были получены синтетические цеолиты (молекулярные сита): А, X и Y, а затем пентасилы (ZSM-5, ультрасил) и многие другие. Здесь обозначения А, X и Y – условные марки фирмы Линде, ZSM-5 – цеолит (Z) фирмы Сокони (S) Мобил (M) 5-й модификации, а ультрасил – марка ГрозНИИ. Каждое обозначение соответствует определенному типу кристаллической структуры.
Состав алюмокислородного каркаса цеолитов одного и того же структурного типа в значительной степени определяет их свойства. Во многих случаях отношение Si/Al в однотипных кристаллах синтетических цеолитов может изменяться в сравнительно широких пределах. Типичными примерами такого рода являются синтетические фожазиты (цеолиты X и Y), синтетические калиевые шабазиты (цеолиты G), синтетические анальцимы.
Из почти ста искусственных Цеолиты на практике широкое применение находят три:
А – Na [AlSiO4]×(2¸3) H2O,
Х – Na [AlSi1–1,5O4–5]×3H2O
Y – Na [AlSi1,5–3O5–8]×(3¸4) H2O.
А не имеет природных аналогов, Х и Y близки фожазиту.
Цеолиты – кристаллические нанопористые твердые тела с диаметром пор приблизительно 1 нм.
Из школьного курса химии Вам известно, что в зависимости от того, какие частицы находятся в узлах решетки, различают ионную, атомную и молекулярныекристаллические решетки. Известны и металлические кристаллические решетки.
В отличие от кристаллических веществ в аморфных веществах такое закономерное расположение частиц не наблюдается.
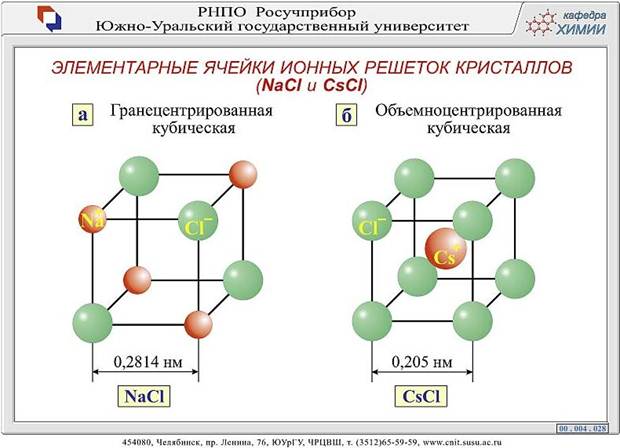
Ионные кристаллические решетки. Такие решетки характерны для ионных соединений. В узлах ионных решеток находятся противоположно заряженные ионы. Типичными представителями этих соединений являются соли. Например, в узлах кристаллической решетки хлорида натрия находятся ионы натрия и хлорид-ионы.
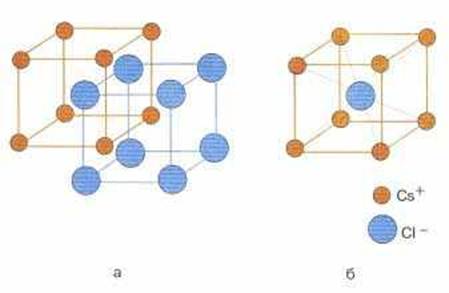
Изображения кристаллической решетки NaCl и CsCl
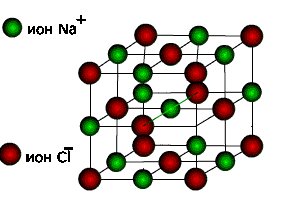
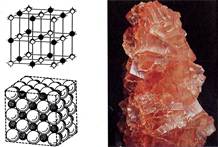
Изображения кристаллической решетки галита (поваренной соли).
В хлориде натрия каждый ион связан (в трех перпендикулярных плоскостях) с шестью противоположно заряженными ионами. Эти ионы находятся на одинаковых расстояниях друг от друга, образуя кристаллы кубической формы. В кристаллах хлорида натрия отдельных молекул хлорида натрия не существует. Весь кристалл представляет собой как бы гигантскую молекулу.
Подобно хлориду натрия большинство солей состоит не из молекул, а из отдельных ионов.
Атомные кристаллические решетки. В узлах атомных кристаллических решеток находятся отдельные атомы, связанные между собой ковалентными связями. Так как атомы, подобно ионам, могут располагаться в пространстве по-разному, то и в этих случаях образуются кристаллы различной формы. Например, в узлах кристаллических решеток алмаза и графита находятся атомы углерода, но из-за различного расположения атомов кристаллы алмаза имеют октаэдрическую форму, а кристаллы графита - призматическую.

а б
Структура алмаза (а) и графита (б)
Молекулярные кристаллические решетки. В узлах молекулярных кристаллических решеток находятся неполярные или полярные молекулы. Например, в узлах кристаллической решетки кислорода (при температуре ниже –219°С) находятся неполярные молекулы О2, в узлах кристаллической решетки твердого хлороводорода (при температуре ниже –144°С) - полярные молекулы НСl. Как и в предыдущих случаях, в зависимости от взаимного расположения молекул в пространстве могут образовываться кристаллы различной формы.
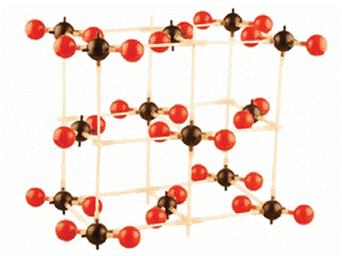
Кристаллическая решетка углекислого газа
Зависимость некоторых физических свойств веществ от типов кристаллических решеток. Существует следующая закономерность:
если известно строение веществ, то можно предсказать их свойства или наоборот: если известны свойства веществ, то можно определить их строение.
http://www.kabinetgeo.narod.ru/lech1_m.htm
Все твердые минералы по своему внутреннему строению делятся накристаллические и аморфные.
Химические элементы (атомы, ионы, молекулы), слагающие минералы, могут располагаться друг относительно друга закономерно, т.е. на определенном расстоянии и в определенном количественном соотношении. В этом случае образуются кристаллы или минералы кристаллического строения. Если же расположение химических элементов хаотичное (неупорядоченное) – образуются минералы аморфного строения.
Роль внутреннего строения является определяющей в совокупности свойств минерала. Поэтому в минералогии выделился раздел науки называемый кристаллографией. По Дэна – это наука о твердых телах и законах, которые управляют их ростом, внешней формой и внутренней структурой.
Закономерное размещение атомов и ионов заключается в следующем. Атомы и ионы, составляющие минералы располагаются в виде узлов геометрических фигур:
Серия таких фигур образует плоскую сетку (модель графита).
Плоские сетки могут располагаться параллельно друг другу и взаимно пересекаться. В этом случае они образуют пространственную решетку. Факт геометрически закономерной кристаллической структуры минералов объясняет ряд важнейших свойств. Рассмотрим некоторые из них.
1. Прежде всего, из этого вытекает само определение кристалла – это твердое тело, имеющее естественную форму многогранника, в котором слагающие частицы (атомы, ионы …) располагаются закономерно по принципу кристаллической решетки.
2. Отсюда способность к самоогранению, т.е. принимать внешние формы, отражающие плоские сетки кристаллической решетки. Элементами самоогранения кристаллов являются грани, ребра, вершины углов. Здесь же важное свойство кристаллов, формулируемое как Закон постоянства гранных углов. Его суть: углы между соответствующими гранями во всех кристаллах одного и того же минерала постоянны. На практике применение этого закона дает возможность, сделав измерения углов, определить минералогическую принадлежность кристалла.
3. Однородность – важное свойство, означающее, что любая часть кристалла обладает теми же свойствами, что и весь кристалл по параллельным направлениям.
4. Анизотропность – свойство однородных кристаллов изменять величину одного и того же физического свойства по не параллельным направлениям. Наглядным примером служат: минерал ДИСТЕН, у которого разная твердость по взаимно перпендикулярным направлениям слюды легко расщепляются по параллельным пластинам, но трудно в перпендикулярном направлении.
Аморфные вещества – изотропны, т.е. все свойства одинаковы по всем направлениям.
5. Симметрия (от греч. symmetria – соразмерность) – свойство кристаллов закономерно повторять “равные части”, т.е. элементы огранения кристаллов, относительно воображаемым вспомогательным элементам, которые называются элементами симметрии. К ним относятся:
Центр С – точка внутри кристалла, которая располагается на равном удалении от элементов огранения (граней, ребер, углов).
Плоскость симметрии Р – воображаемая плоскость, делит кристалл на равные зеркально отраженные части.
Ось симметрии L – воображаемая линия, вокруг которой несколько раз повторяются равные части фигуры. Поскольку кристалл можно повернуть на 360 о, то количество совмещений элементов его огранения составляет 2, 3, 4, 6 раз. Эти числа определяют порядок оси, запись делают: L2 – что означает ось второго порядка.
Кроме обычных осей, существуют инверсионные (поворотные) оси (редко встречаются). Они определяются при одновременном повороте кристалла вокруг оси симметрии и вокруг центра.
Полный набор элементов симметрии данного кристалла называется видом симметрии или классом. Установлено, что существует 32 класса. Запись полной совокупности элементов симметрии кристалла от высших к низшим называется формулой симметри и – например L33L23PC.
Классы объединяются в сингонии. Сингония – это группа видов симметрии, которая обладает одним или несколькими общими элементами симметрии. Всего установлено 7 сингоний. В свою очередь, сингонии объединяются в 3 категории – низшую, среднюю и высшую.
|
|
Дата добавления: 2014-01-04; Просмотров: 3562; Нарушение авторских прав?; Мы поможем в написании вашей работы!