
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Обманная адсорбция
|
|
|
|
Если на поверхности адсорбента уже адсорбирован электролит, то при контакте этого сорбента с другим электролитом почти всегда в той или иной степени наблюдается обменная адсорбция, или, правильнее, обмен ионов между двойным электрическим слоем адсорбента и средой. При обменной адсорбции адсорбент, поглощая определенное количество каких-либо ионов, одновременно выделяет в раствор эквивалентное количество других ионов того же знака, вытесненных с поверхности.
К обмену способны не только чужеродные ионы с адсорбированными адсорбентами, но и ионы, образующиеся из самого адсорбента в результате диссоциации его молекул. При этом поверхностное явление, каким является адсорбция, может переходить в объемное явление, т. е. в обмене могут участвовать ионы, расположенные в глубинных слоях адсорбента, если только к ним возможен доступ раствора. В частности, это происходит при обмене ионов на пермутите натрия (Na2[Al2Si2O8] . nH2O – искусственно приготовленные гидратированные алюмосиликаты – пермутиты) и ионообменных смолах, о которых будет сказано ниже. Понятно, что вещества, способные к объемному обмену ионов, обладают особенно высокой емкостью поглощения соответствующего иона из раствора.
Обменная адсорбцияимеет ряд особенностей.
1. обменная адсорбция специфична, т. е. к обмену способны только определенные ионы. Иными словами, на обменную адсорбциюсильно влияет как природа твердой фазы и имеющегося на ней двойного электрического слоя, так и природа адсорбируемого иона. В зависимости от химической природы ионов, которые могут обмениваться с ионами, содержащимися в адсорбентах, различают кислотные и основные адсорбенты. Кислотные адсорбенты ведут себя подобно кислоте и способны обменивать с растворами катионы; основные адсорбенты сходны по свойствам с основаниями и обменивают анионы. Впрочем, существует много амфотерных адсорбентов, которые в одних условиях обменивают катионы, а в других – анионы. Специфичность обменной адсорбции указывает на то, что по своей природе этот процесс приближается к химическим явлениям.
|
|
|
2. обменная адсорбция не всегда обратима.
3. обменная адсорбция, как правило, протекает более медленно, чем молекулярная адсорбция. Особенно медленно она протекает, когда происходит обмен ионов, находящихся в глубине адсорбента. Очевидно, в данном случае время необходимо для того, чтобы ионы из раствора продиффундировали в глубь адсорбента и вытеснили оттуда ионы, которые в свою очередь должны перейти в раствор.
4. при обменной адсорбции может изменяться рН среды. Это наблюдается в том случае, когда ионом, обмениваемым адсорбентом, является водородный или гидроксильный ион. Если адсорбент заменяет на какой-нибудь катион водородный ион, то последний, поступая в раствор, уменьшает рН среды, при этом адсорбент ведет себя подобно кислоте. Если адсорбент меняет на какой-нибудь анион гидроксильный ион, то рН раствора, наоборот, увеличивается, причем адсорбент ведет себя как основание. Наглядно обмен ионов в обоих этих случаях можно изобразить следующими схемами:


Б. П. Никольский (1939 г.) предложил уравнение, количественно характеризующее обмен ионов 1 и 2 на твердой поверхности:
 (1)
(1)
где g1, g2 – содержание обменивающихся ионов в адсорбенте, г-экв/г;
a1, a2 – активности обменивающихся ионов в растворе;
z1, z2 – валентность ионов;
k – константа.
При z1 = z2 = 1 уравнение упрощается:
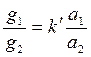 (2)
(2)
При небольших концентрациях электролита вместо активности а можно пользоваться значением концентрации. В этом случае уравнение (2), связывающее адсорбционную способность ионов 1 и 2 с их концентрацией в растворе, принимает вид:
|
|
|
 (3)
(3)
Обменная адсорбцияимеет большое значение в земледелии, биологии и технике. Почва способна поглощать и удерживать определенные ионы, например катионы К+ и NH4+, содержащиеся в удобрениях и необходимые для питания растений. Взамен этих катионов почва выделяет эквивалентные количества других катионов, например Са2+ и Mg2+. Анионы, как, например, Сl–, NO3–, SO4–2, почти не поглощаются почвой. Согласно К. К. Гедройцу (1933 г.), детально исследовавшему явление обмена ионов в почве, поглощать основания способен так называемый поглощающий комплекс – высокодисперсная смесь нерастворимых алюмосиликатов и органоминеральных соединений. От природы поглощенных ионов в значительной мере зависят физические и агротехнические свойства почвы.
В технике обменная адсорбция имеет существенное значение. Например, при крашении растительного волокна оно адсорбирует из среды окрашенные катионы красителя, выделяя эквивалентное количество ионов кальция, всегда присутствующих в техническом волокне. Здесь следует отметить, что очень часто явление обмена обусловлено не самим веществом адсорбента, а содержащимися в адсорбенте незначительными примесями.
Обменная адсорбцияшироко применяется при умягчении воды. Как известно, наличие в воде больших количеств солей жесткости (ионов Са2+ и Mg2+) очень часто затрудняет применение такой воды в технике. Мыла в жесткой воде переходят в форму нерастворимых кальциевых и магниевых мыл и теряют свое моющее и стабилизующее действие. Применение жесткой воды в паровых котлах приводит к образованию на их стенках накипи, понижающей теплопроводность и увеличивающей потери тепла, а в отдельных случаях может явиться причиной взрыва котла (из-за местного перегревания и постепенного изменения структуры металла). Пища, сваренная в жесткой воде, обычно безвкусная и твердая. Для умягчения жесткой воды Ганс предложил применять алюмосиликатный поглотитель, названный им пермутитом, состав которого можно выразить следующей формулой:
Na2O . Al2O3 . 3SiO2 . 2H2O
В настоящее время вместо относительно дорогого пермутита натрия для умягчения воды применяют также природные минералы – глаукониты.
|
|
|
Глауконит – минерал, силикат сложного состава. Встречается обычно в виде мелких зерен зеленого цвета, главным образом в морских песчаниках и известняках. Образуется на шельфе на глубинах 200–300 м. Широко используется для определения изотопного возраста горных пород калий-аргоновым методом.
Умягчение жесткой воды с помощью пермутита можно пояснить следующей схемой:
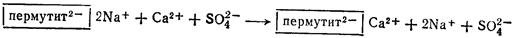
Пермутит, обменявший Na+ на Са2+, в согласии с законом действия масс, можно снова легко регенерировать путем обработки концентрированным раствором поваренной соли. При этом ионы Na+ вытесняют ионы Са2+ в раствор, и после промывки пермутит снова пригоден для применения. Нетрудно видеть, что обработка жесткой воды пермутитом ведет к ее умягчению, но не к деминерализации.
В последние годы вместо пермутита и глауконитов для умягчения воды широко применяют ионообменные смолы и цеолит.
Обменная адсорбция используется также для улавливания ценных веществ из чрезвычайно разбавленных растворов, из которых выделять эти вещества другими методами нерентабельно. Таким образом, можно регенерировать, например, медь из рудничных вод и сточных вод производства искусственного медноаммиачного шелка; серебро из сточных вод фабрик, изготовляющих кинопленку; хром из электролитических хромовых ванн и т. д. Обменная адсорбция применяется при извлечении из растворов радиоактивных элементов.
Наконец, на обменной адсорбции основано также точное установление эквивалентной точки при титровании растворов в аналитической химии. Например, если раствор хлорида натрия титровать в присутствии флуоресцеина нитратом серебра, то пока в растворе имеется хотя бы небольшой избыток хлорида натрия, на поверхности образующихся кристаллов AgCl будет возникать двойной электрический слой, состоящий из ионов Сl– и ионов Na+. В результате этого выделяющийся осадок будет белым, а раствор имеет желто-зеленую окраску. Однако как только в растворе окажется небольшой избыток нитрата серебра, на поверхности кристаллов AgCl образуется уже двойной слой из ионов Ag+ и NО3–. Так как окрашенный анион флуоресцеина обладает большой адсорбционной способностью, он вытеснит из двойного электрического слоя ион NО3– и в результате этого осадок окрасится в желто-зеленый цвет, раствор же станет бесцветным. Такое изменение окраски наступает весьма резко, что позволяет легко устанавливать эквивалентную точку при титровании.
|
|
|
ФЛУОРЕСЦЕИ¢Н – оксиксантеновый краситель; оранжево-красные кристаллы, плохо растворимые в воде; применяется как кислотный краситель для окрашивания не текстильных материалов в жёлтый цвет, как адсорбционный и кислотно-основной индикатор, как трассёр при изучении направления движения подземных вод и др.
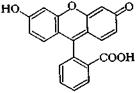
Флуоресцеин
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 711; Нарушение авторских прав?; Мы поможем в написании вашей работы!